
本文梳理了慢病毒包装的全部流程,并结合具体实例介绍了慢病毒包装的方法、步骤,并对包装过程中的关键点进行了细致的分析。使初学者也能握毫无障碍地自主完成病毒包装、纯化、滴度测定等实验。
(温馨提示:慢病毒包装过程中,遇到任何问题,或者对文章内容有疑问可随时与我们联系,亦可使用慢病毒包装试剂盒快速完成病毒包装。)
以293T细胞为例:
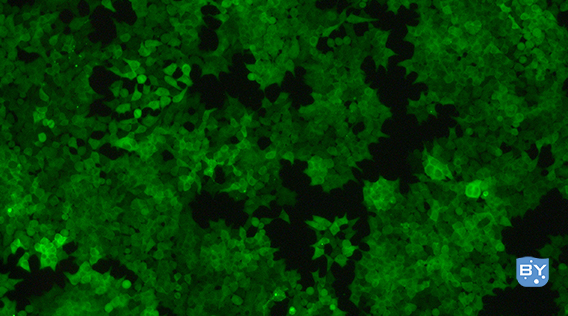
慢病毒感染293T细胞
1.293T细胞分盘
转染前一天,将已经长好的细胞以合适的比例传代到10cm培养皿中,当细胞长到80%时准备转染,步骤如下:
1)弃去培养液,加入5 mL 灭菌PBS溶液,轻轻晃动,洗涤细胞生长面,然后弃去 PBS 溶液。
2)用2 mL 胰蛋白酶消化对数生长期的293T细胞。
3)以含10%血清的培养基调整细胞密度为5 ×106个/10 mL,重新接种于10cm细胞培养皿中,37 ℃,5% CO2 培养箱继续培养,转染前细胞密度80%左右。
注意:293T细胞的状态非常重要,一般建议购买新的细胞株后分批多次冻存,以保证每次包装病毒时细胞的代数不会超过10代。同时尽量不要使用国产血清。复苏后的细胞需要传2代后才能进行病毒的包装,并且传达后18-24h需要密度达到80%左右。
2.转染前换液
转染前1~2h 将需要转染的细胞换新鲜的培养基,8mL/10cm皿。
注意:293T细胞贴壁性不是很好,换液时应小心滴加尽量避免冲起细胞。
3.转染
(1)以一个10cm平皿为例,取2个EP管,分别加入500 µl生理盐水,标记为A、B;
(2)A管加入60µg PEI,并充分涡旋混匀,B管加入过表达质粒和两个辅助质粒pSPAX2、pMD2.G,三质粒比例为4:3:1,共24µg;
(3)将A管PEI加入到B管中,轻轻混匀,静置20min;将混合液加入细胞中,过夜培养。
注意:质粒提取的质量,包括浓度和纯度。浓度至少要超过500ng/ul,因为浓度低,加入的体积就会相应增大,会增加细胞污染的风险。纯度可以使用核酸测定仪进行检测,260/280在1.8-2.0之间。有条件的可以选择去内毒素试剂盒进行提取,会对病毒的产量有帮助。同时,由于辅助质粒使用频率高,可以选择进行大提,分装低温保存,保证后续包病毒质粒的稳定性。
4.换液
转染过夜后,小心吸掉细胞培养液弃于盛有消毒液的废液杯中,然后加10mL新鲜的细胞培养基继续培养。
注意:此时弃去的培养基中已含有少量的病毒,必须经处理后才能丢弃,所用的移液枪头等必须经消毒液浸泡至少15min后才能丢弃。
加入的新鲜培养基一般选择FBS浓度为2%-5%,可以根据细胞的生长状态来选择。
5.病毒收集
换液后48h,收集细胞上清液于50mL离心管,4度保存。并根据细胞生长状况适当补充新鲜细胞培养基(含2%-5% FBS的DMEM)。
24h后再次收集细胞上清液于同一个50mL离心管。4℃,4500g离心20min,上清液用0.45μm滤器过滤后转移到新的离心管。过滤后的细胞上清液如果暂时不进行进一步处理,请及时于-80℃储存。
注意:细胞转染后24h就可以看到荧光蛋白的表达,48h可以进行荧光照片的采集,判断转染效率。一般为了能获得高滴度的病毒,需要通过不断优化条件,提高转染效率。优化条件包括:三质粒的比例优化,转染试剂的优化,细胞培养条件的优化等。
6.慢病毒的浓缩与纯化
病毒过滤后需进行浓缩,采用PEG8000方法浓缩病毒;
(1)5X PEG8000 —NaCl配制:称取NaCl 8.766 g; PEG8000 50g溶解在200ml Milli-Q纯水中;121摄氏度 30min 湿热灭菌 30min;保存在4℃;
(2)每30ml过滤后的病毒初始液,加入5X PEG-8000 —NaCl母液7.5 ml;
(3)每20~30min混合一次,共进行3-5次;
(4)4度放置过夜;
(5)4度,4000 g,离心 20min;
(6)吸弃上清,静置管子1~2分钟,吸走残余液体;
(7)加入适量的慢病毒溶解液溶解慢病毒沉淀;
(8)溶解后的病毒悬液分装成小份,保存于-80 ℃,避免反复冻融。
注意:试剂尽量选择sigma公司,同时需要保证配置的准确性。离心后可以直接看到病毒沉淀,吸走液体时要小心,不要吸走了沉淀。溶解时如果发现很难吹打,可以适当的静置一会再去吹打混匀。病毒溶解后需要及时分装保存,避免使用时反复冻融。
7.病毒滴度的测定
(1)将生长状态良好的293T细胞消化计数后稀释至1×105/ml,加入96孔板,100μl/孔。放入37℃,5%CO2培养箱中培养;
(2)在EP管中做10倍梯度稀释,连续10个稀释度。稀释方法如下:每种病毒准备10个1.5ml EP管,每管加入900μl培养液,往第一个管中加入100μl病毒原液,混匀后,吸取100μl加入第二个管混匀。依此类推,做十个稀释度,每个稀释度做4个重复孔;
(3)吸取96孔板中原有的培养基,加入稀释好的病毒液100μl;
(4)两天后在每个孔再加入100μl完全培养液,利于细胞的生长;
(5)第五天在荧光显微镜下观察结果,并数出最后两个有荧光的荧光细胞克隆数。假设为X和Y,则滴度(TU/ml)=(X+Y*10)*1000/2/X孔的病毒液的含量(μl)。
注意:浓缩后的病毒可以适当将起始稀释度增大,避免病毒的浪费。条件允许的情况下可以每个稀释度多做些重复,保证实验结果的可靠性。病毒滴度是在293T细胞上测定的,不代表其感染其它细胞的能力。所以当病毒感染其它细胞时,需要多做几个MOI的梯度,以确保感染效果的最佳化。
8.案例图片展示

慢病毒感染SUNE细胞
 文章推荐
文章推荐