
细胞复苏是与细胞冻存相反的过程,即是细胞恢复生长的过程,是细胞培养技术中的核心环节!
一、细胞复苏基本步骤
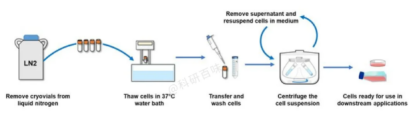
1. 从液氮容器中取出冻存管,直接浸入37℃温水中,并不时摇动令其尽快融化
2. 从37℃水浴中取出冻存管,打开盖子,用吸管吸出细胞悬液,加到离心管并滴加10倍以上培养液,混匀
3. 离心,1000rpm,5min
4. 弃去上清液,加入含10%小牛血清培养液重悬细胞,计数,调整细胞密度,接种培养瓶,37°C培养箱静置培养
5. 次日更换一次培养液,继续培养
二、细胞复苏常见问题
1.细胞活力低或死亡
【可能原因】
l 冻存液质量差(如DMS0未预冷或污染)或配比不当
l 冻存前细胞状态差(如代次过高、未处于对数生长期)
l 解冻速度过慢或温度变化剧烈,导致冰晶损伤
l 冻存程序不当(如未使用程序降温盒直接放入液氮)
【应对方法】
l 选择优质冻存液(如预冷的有血清或无血清冻存液),避免DMSO局部浓度过高
l 冻存处于对数生长期的健康细胞(贴壁细胞汇合度约80%,悬浮细胞活力>90%)
l 快速解冻:将冻存管浸入37℃水浴,轻柔晃动使其在1~2分钟内全部融化
l 使用程序降温盒(以1°C/min降至-70℃后再转移至液氮保存)
2.细胞难以贴壁
【可能原因】
l 冻存前消化过度(胰酶作用时间过长或浓度过高)
l 复苏后离心速度过高或吹打力度过大,导致细胞破碎
l 培养条件不适宜(如二氧化碳浓度错误、培养基未预热)
l 微生物污染(如水浴时水渗入冻存管)
【应对方法】
l 冻存前控制消化时间,当80%细胞脱落后立即终止消化
l 低速离心(建议250-1000rpm,3~5分钟)并轻柔吹打细胞悬液
l 确保培养基与细胞类型匹配,预热至37℃,并检查二氧化碳浓度
l 严格无菌操作:用PE手套包裹冻存管水浴,复苏后酒精擦拭管口
3.细胞贴壁后生长缓慢或停滞
【可能原因】
l 冻存细胞密度过低或已进入衰老期
l DMS0未充分去除(对部分敏感细胞毒性大)
l 基因工程影响(如必需基因敲除或过表达产物抑制增殖)
【应对方法】
l 冻存时调整细胞密度至5x105~1x106个/mL,避免使用高代次细胞
l 离心去除冻存液中的DMSO,或直接稀释10倍后贴壁换液
l 对基因工程细胞(如敲除/过表达株),评估基因必要性或更换宿主细胞
4.细胞污染
【可能原因】
l 冻存管密封不严,水浴时液体渗入
l 操作环境或试剂污染(如支原体、细菌)
【应对方法】
l 冻存前检查管盖密封性,水浴时避免水面淹没管口
l 定期检测细胞及试剂微生物污染,对实验室进行过化氢熏蒸
5.操作失误
【可能情况】
l 解冻后未及时处理(冻存液长时间残留)
l 运输过程中温度波动(如未使用干冰或冰盒保冷)
【应对方法】
l 解冻后立即离心或稀释,减少DMSO暴露时间
l 远距离转移冻存管时,使用干冰或隔热容器维持低温
 文章推荐
文章推荐