
提到细胞凋亡,想必大家都不陌生,咱们这个领域的,先不说本科的时候学过,考研的时候怎么说它也是重要考点之一。或许此时您的脑袋瓜子里立马浮现出课本上那个经典的凋亡信号通路图......额,还有点记不清......没关系,今天小编带您回顾一下经典的细胞凋亡信号通路,再看看它常见的检测方法。
☆细胞凋亡
细胞凋亡是一种细胞主动有序的死亡,它涉及一系列基因的激活、表达以及调控等作用,它并不是病理条件下自体损伤的一种现象,而是为了更好地适应生存环境而主动争取的一种死亡。
细胞凋亡相关信号通路

图片来自:https://www.cellsignal.cn/
凋亡信号通路主要包括Caspase依赖型细胞凋亡和Caspase非依赖型细胞凋亡。

☆细胞凋亡常用检测方法
想要了解凋亡常用的检测方法,首先要知道凋亡的形态学变化。形态学观察细胞凋亡的变化是多阶段的,细胞凋亡往往涉及多个细胞,即便是一小部分细胞也是非同步发生的。首先出现的是细胞体积缩小,连接消失,与周围的细胞脱离,然后是细胞质密度增加,接下来会发生一系列的变化:线粒体膜电位消失;通透性改变;释放细胞色素C到胞浆;核质浓缩,核膜核仁破碎;DNA降解成为约180bp-200bp片段,胞膜有小泡状形成;膜内侧磷脂酰丝氨酸外翻到膜表面;胞膜结构仍然完整,最终可将凋亡细胞遗骸分割包裹为几个凋亡小体,无内容物外溢。
细胞凋亡检测通常有形态学观察方法、DNA凝胶电泳、酶联免疫吸附法(ELISA)核小体测定、流式细胞仪定量分析、Western blot检测等。
(1)形态学观察
电镜观察:可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体及凋亡小体被临近吞噬细胞吞噬现象。

电子显微镜观察Jurkat细胞凋亡过程中核染色质的形态学改变
(2)DNA凝胶电泳
细胞凋亡时主要生物化学特征是其染色质发生浓缩,染色质DNA在核小体单位之间的连接处断裂,形成180~200bp整数倍的寡核苷酸片段,在凝胶电泳上表现为梯形电泳图谱(DNA ladder)。通过提取DNA、电泳、UV下可见DNA ladder。此方法是判断细胞有无凋亡发生的一种简便方法,比较适用于体外培养的非增殖性细胞的检测。
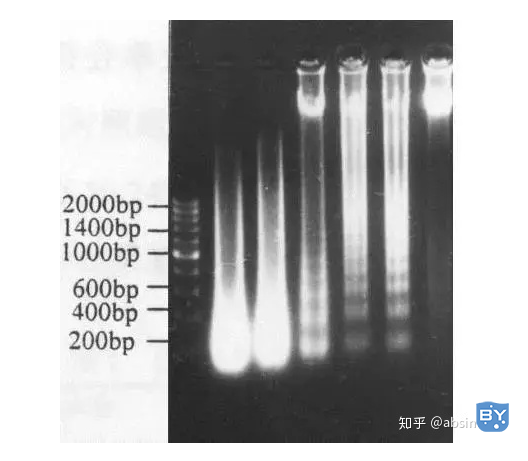
泳道1:DNA ladder 泳道2-3:坏死 泳道4-6:凋亡 泳道7:正常细胞
(3)酶联免疫吸附法(ELISA)核小体测定
凋亡细胞的DNA断裂使细胞质内出现核小体。核小体由组蛋白及其伴随的DNA片断组成,可由ELISA法检测。
检测步骤
① 将凋亡细胞裂解后高速离心,其上清液中含有核小体;
② 在微定量板上吸附组蛋白体;
③ 加上清夜使抗组蛋白抗体与核小体上的组蛋白结合;
④ 加辣过氧化物酶标记的抗DNA抗体使之与核小体上的DNA结合;
⑤ 加酶的底物,测光吸收值。
此方法优点:敏感性高、应用广泛、操作简单;缺点:不能精确定量。
(4)Annexin V/PI法
正常细胞中,磷脂酰丝氨酸(phosphotidylserine,PS)位于细胞膜的内侧,但在早期凋亡细胞中,PS会从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin-V(膜联蛋白-V)是一种分子量为35-36KD的Ca2+依赖性磷脂结合蛋白,能与PS高亲和力结合。用荧光素(FITC、Alexa Fluor488等)标记的Annexin-V作为探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。碘化丙啶(propidine iodide, PI)是一种核酸染料,它不能透过完整的细胞膜,但在凋亡中晚期的细胞和坏死细胞,PI能够透过细胞膜而将细胞核染红。因此将Annexin-V与PI结合使用,就可以检测出细胞群体中的早期凋亡细胞与晚期凋亡细胞。

B3象限:Annexin V-/PI-:活细胞; B4象限:Annexin V+/PI-:早期凋亡细胞; B2象限:Annexin V+/PI+:晚期凋亡细胞; B1象限:Annexin V-/PI+:坏死细胞。
(5)TUNEL法
细胞凋亡中,染色体DNA双链断裂或单链断裂而产生大量粘性3'-OH末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到DNA的3'末端,从而可进行凋亡细胞的检测,这类方法称为脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)。
常用的标记系统:生物素标记的dUTP、地高辛标记的dUTP、荧光素标记的dUTP、溴分子标记的dUTP;
常用的显色系统:Anti-biotin/digoxin/biotin- HRP和DAB;FITC-dUTP/BrdU和流式细胞仪。

(6)Western blot检测
分析Procaspase-3的活化,以及活化的Caspase-3及对底物多聚(ADP-核糖)聚合酶[poly(ADP-ribose)polymerase,PARP]等的裂解。
Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中caspase-3为关键的执行分子,它在凋亡信号传导的许多途径中发挥功能。Caspase-3正常以酶原(32KD)的形式存在于胞浆中,在凋亡的早期阶段被激活,活化的Caspase-3由两个大亚基(17KD)和两个小亚基(12KD)组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。但在细胞凋亡的晚期和死亡细胞,caspase-3的活性明显下降。

使用abs131825 - Caspase-3 Antibody (上)或 Cleaved Caspase-3 (Asp175) Antibody(下)对未经、经十字孢碱处理(3 小时,1 µM,体内)或经细胞色素 c 处理(1 小时,0.25 mg/ml,体外)的 HeLa、NIH/3T3 和 C6 细胞提取物进行蛋白质印迹分析。
(7)荧光分光光度计分析
活化的Caspase-3能够特异切割D1E2V3D4-X底物,水解D4-X肽键。根据这一特点,设计出荧光物质偶联的短肽Ac-DEVD-AMC(caspase-3四肽荧光底物 )。在共价偶联时,AMC不能被激发荧光,短肽被水解后释放出AMC,自由的AMC才能被激发发射荧光。根据释放的AMC荧光强度的大小,可以测定caspase-3的活性,从而反映Caspase-3被活化的程度。

Hela 细胞96孔板中培养,并孵育过夜。细胞用不同浓度的 Staurosporine #9953(5小时)处理,随后裂解。细胞裂解物与底物溶液一起混合,并在 37ºC下放在阴暗处孵育2小时,以获得相对荧光单位 (RFU)。
(8)其他凋亡相关因素分析
1)△Ψm dissipation(线粒体跨膜电位的消失):TMRM(发红色荧光),细胞膜荧光探针DiOC6(3),碘化物(发绿色荧光)、Rhodamine 123(发黄绿色荧光)、JC-1(单体形式绿色荧光;多聚体形式红色荧光)【abs50016-100T:线粒体膜电位检测试剂盒(JC-1)】,这些染料对线粒体膜电位非常敏感,其荧光的增强或减弱说明线粒体内膜电负性的增高或降低。
2)细胞内氧化还原状态改变的检测:通过荧光染料Monochlorobimane(MCB)体外检测凋亡细胞细胞质中谷胱甘肽的减少来检测凋亡早期细胞内氧化还原状态的变化。
3)检测线粒体产生的ROS:无荧光的HE(氢化乙啶)可被ROS氧化为EthBr(溴乙啡啶),发红色荧光。NAO(烷化吖啶橙,可发荧光)能与非氧化的心磷脂(可被ROS氧化)反而失去荧光。
 文章推荐
文章推荐