
血管生成在肿瘤的发展转移过程中起到重要作用。小管形成实验是测量在体外血管生成的一种快速的、可量化的方法。一般做的多的是研究内皮细胞的小管形成。内皮细胞结合条件培养基接种于一定基底上,易形成三维网状结构。然后通过图像分析软件对小管结果进行定量分析。
一、血管形成实验步骤
1. 细胞的准备
用于成管的细胞一定要代数少,状态好。像常用的HUVEC的细胞系一般多采用7代以内细胞活力最好的时候用于成管试验,若细胞状态不佳成管则较困难。
2. 基质胶的准备
目前基质胶都采用的是Corning公司的Matrigel。
(1)Matrigel的成分:
Matrigel是来源于EHS小鼠肉瘤的基底膜基质,其中含有约60%层粘连蛋白、30% IV 胶原和8%的巢蛋白,还含有基底膜聚糖、TGF-ß、表皮生长因子、类胰岛素生长因子、组织纤溶酶原及其他生长因子。
(2)Matrigel的种类:
Corning公司Matrigel主要有常规标准型(Standard)、高浓度(HC)、无酚红(Phenol red-free)、生长因子减量型(Growth factor reduced, GFR)和人胚胎干细胞专用(hESC-qualified)几个类别。
标准型Matrigel:浓度范围大致为8-12mg/ml
高浓度Matrigel:浓度范围大致为18-22mg/ml
无酚红Matrigel:不含酚红,产品完全融化后颜色透明
生长因子减量型Matrigel:Matrigel里包含的生长因子经过减量处理
人胚胎干细胞专用Matrigel:经过对hESC培养的测试,可以用于人胚胎干细胞的培养
(3)Matrigel的选择:
我们一般选择经济适用款——标准型Matrigel,基本上就可以满足实验要求。但由于实验要求Matrigel浓度大于10mg/mL,所以购买前,要咨询厂家,选取浓度在10mg/mL以上的批次。已购买的,可以在Corning官网:https://www.corning.com/asean/en/products/life-sciences/resource-library.html进入质检证书查询页面,输入货号与批号,点击查找,获得相应COA文件。该文件中有蛋白浓度的说明。
3. 实验流程
(1)第一天matrigel放入4℃冰箱过夜。第二天待matrigel冻融后,4℃离心数分钟。冰上操作。matrigel用预冷枪头混匀,EP管提前预冷,每500ul分装。
(2)24孔板和1ml的头放置冰箱或冰上预冷30min。很多人选择96孔板,但其Matrigel基质胶比较难铺平,细胞不易铺匀,拍照也不方便。
(3)取250μl/孔Matrigel基质胶加入24孔板中,加入时避免产生气泡,置于细胞培养箱中60min待其凝固。
(4)取1ml含EDTA的胰酶消化细胞,待消化完全后,加入含血清培养液终止消化,计数后用培养基重悬细胞并调整细胞密度为2-3 x 105个/ml。(细胞浓度对于成管也起到至关重要的作用,初次做,建议细胞浓度做几个梯度——1 x 105 ;2 x 105;4 x 105个/ml......)
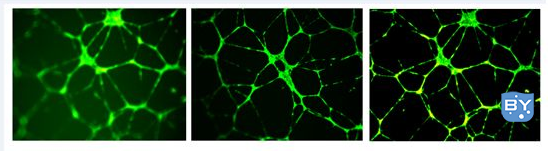
(5)胶凝固后,取出24孔板,每孔加入500μl细胞悬液,做好标记后放入细胞培养箱常规培养3~6h(细胞种类,接种量,对成管时间有一定的影响,基本上3h就开始有小管形成,随着时间的推移,成管量增加,但达到一定时间后,形成的小管会逐渐瓦解,所以要选取合适的时间点拍照。如下图:

(6)分析:100、200倍显微镜下随机5个视野观察计数血管内皮细胞小管分枝、小管数、小管长度等。可以根据需要进行calcein荧光染色,如下图:
 文章推荐
文章推荐