“疼痛”有了创新思路也能上Nature子刊!西安交大团队揭示慢性神经病理性疼痛中的ACC-VTA-ACC正反馈环路!
2024-12-20 17:49:03
|
访问量:16732
“腰疼、腿疼、颈椎疼……”,长期伏案学习的生物医学科研人应该知道,疼痛其实是机体对损伤组织或潜在的损伤产生的一种不愉快的反应,是一种复杂的生理心理活动,也是临床上最常见的症状之一。那么,关于“疼痛”能有什么样的研究新思路呢?!
今天我们将分享一篇发表于中科院1区期刊Nature Neuroscience,影响因子为21.2的高分文献,名为《ACC-VTA-ACC正反馈回路介导神经性疼痛的持续和情绪后果》,我们可以结合案例了解一下关于“疼痛”的课题设计思路~

【文章题目】:ACC-VTA-ACC正反馈回路介导神经性疼痛的持续和情绪后果
【发表期刊】:Nature Neuroscience
【影响因子】:IF=21.2
【发表日期】:2024.02
一、研究背景
①外周神经系统(例如外周伤害感受器的敏化)和中枢神经系统(包括中枢敏化)可塑性的各种不适应变化可能导致慢性疼痛。
②三环抗抑郁药可以通过未知的机制减轻神经性疼痛的感觉和情感症状。③中脑边缘多巴胺(DA)通路支配涉及情感和动机功能的大脑区域。④DA通路的药物靶向作用影响了慢性疼痛治疗过程中对阿片类和非阿片类镇痛药的反应性。
二、技术路线
三、研究结果
1.VTADA神经元活性低下介导神经性疼痛的焦虑抑郁样行为和异常性疼痛
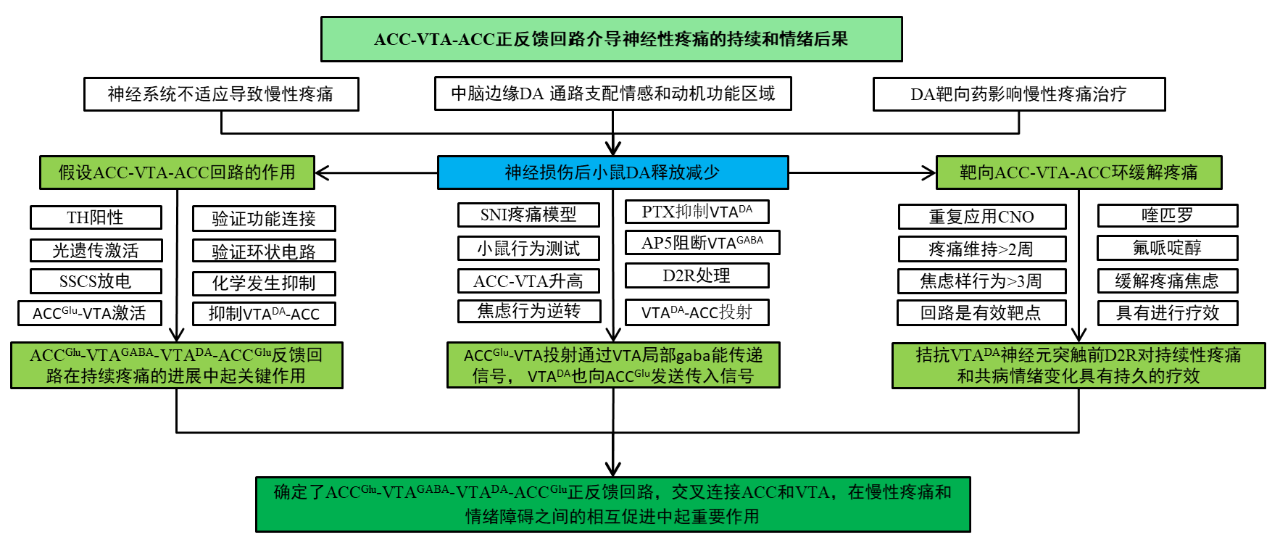
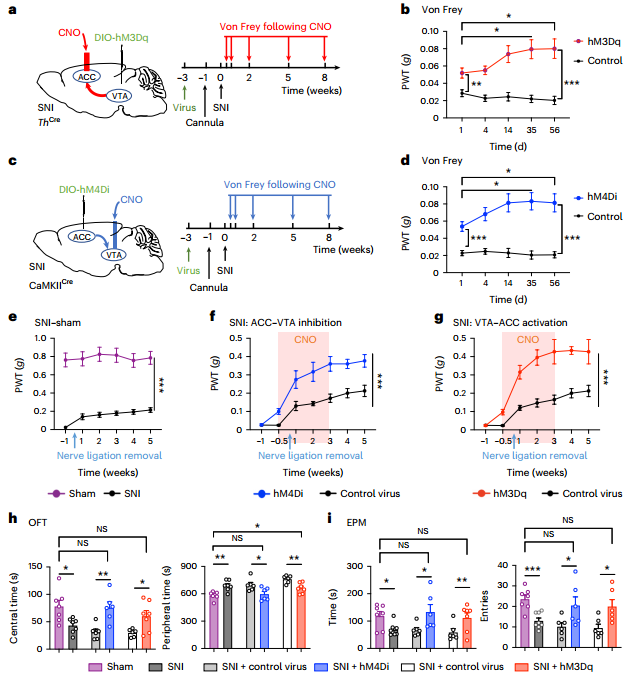
为了研究中脑腹侧被盖区(VTA)DA神经元在持续性疼痛进展中的功能参与,作者在小鼠中建立了保留性神经损伤(SNI)诱导的神经性疼痛模型,如图1a的von Frey实验所示,同侧后爪出现持续的机械性痛觉过敏。图1b实验结果显示,与临床报告一致,SNI小鼠在手术后6周表现出强烈的焦虑抑郁样行为,在旷场实验(OFT)中,运动活动正常的小鼠在中心区停留的时间较少,在外周区停留的时间较多。图1c~e显示,它们在高架迷宫(EPM)的张开双臂中花费的时间也更少;SNI后6周,自发和电流诱发动作电位(APs)的频率均大幅降低,表明VTADA神经元在神经性疼痛的维持阶段而非诱导阶段兴奋性降低;并且SNI小鼠NAc中DA释放的峰值幅度和总电荷大大降低。这些结果表明神经损伤后小鼠DA释放减少。
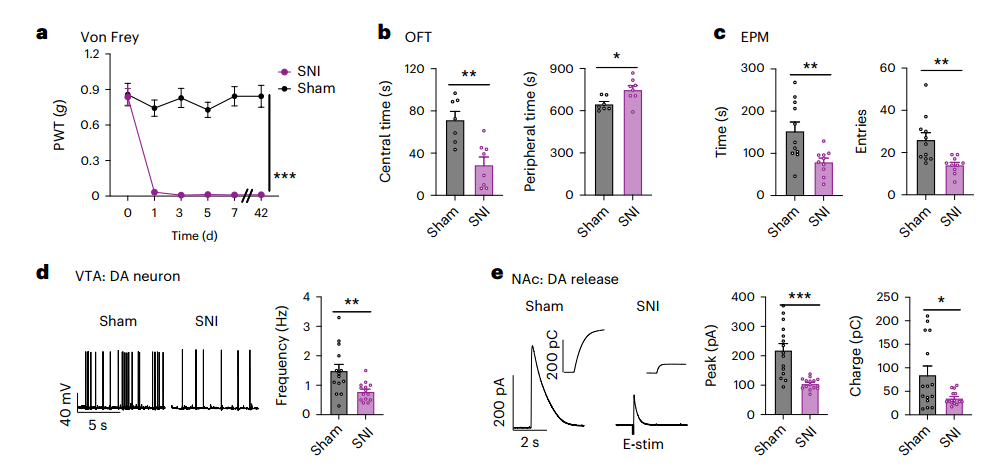
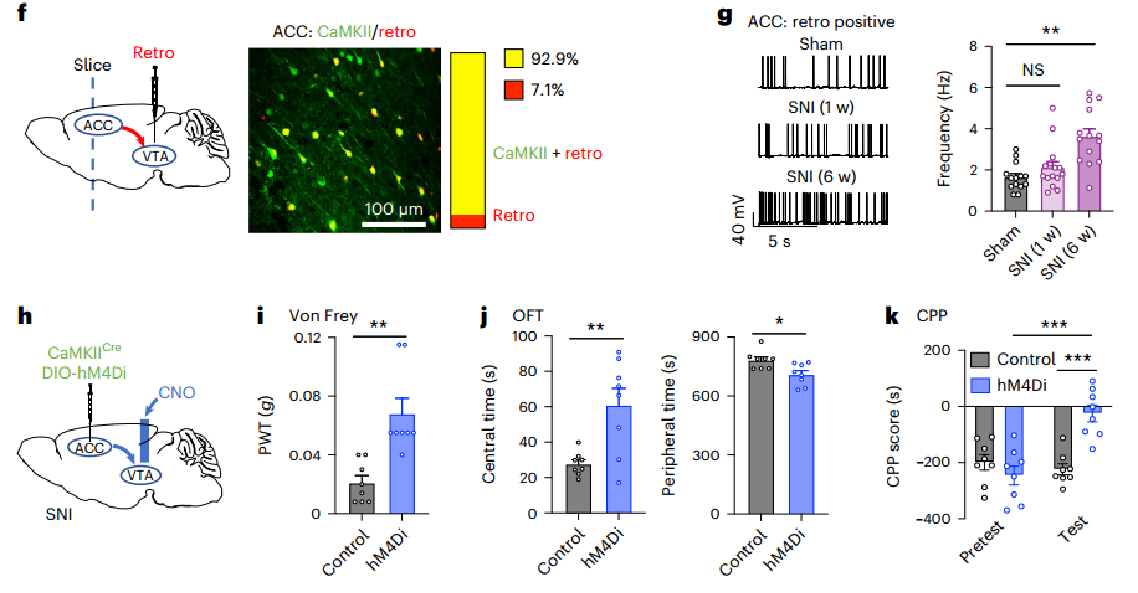
接着,作者将逆行病毒注射到侧向VTA中,发现主要在V层成功标记了前扣带回(ACC)神经元。图1f显示,大多数逆行标记的神经元与钙调素依赖性蛋白激酶II(CaMKII)免疫染色共定位。图1g则显示,逆行病毒标记的ACC神经元在SNI小鼠中显示出时间依赖性的放电率增加,这表明在持续疼痛的发展过程中,ACC-VTA投射的兴奋逐渐升高。图1h~i显示,术后6周,ACCGlu-VTA的化学发生抑制显著减轻了SNI诱导的机械超敏反应。同样,如图1j~k所示,SNI小鼠的焦虑样行为和厌恶行为也被化学发生抑制完全逆转。这些结果表明,活跃的ACCGlu-VTA投射在神经损伤后持续疼痛期间介导焦虑共病中起关键作用。
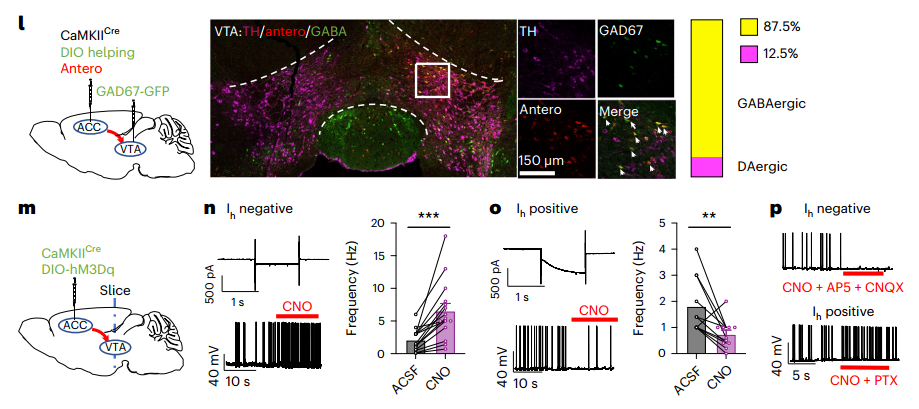
3.ACCGlu神经元通过局部GABA传递支配VTADA神经元
我们可以从图1l看到,大多数(87.5%)携带逆行病毒的细胞与VTAGABA(GAD67阳性)神经元共定位,只有少数细胞与VTADA(TH阳性)神经元共定位。我们还可以从图1m看到,作者将CaMKIICre和表达Cre依赖性hM3Dq的病毒共同注射到ACC中,并将超极化激活的阳离子电流(Ih)作为VTADA神经元的电生理标记。图1n显示,Ih阴性(VTAGABA)神经元的放电率随着氯氮平N-氧化物(CNO)的应用而增加,这被谷氨酸受体拮抗剂AP5和氰喹啉(CNQX)阻断。相比之下,图1o~p则显示,CNO灌注大大降低了VTADA神经元(Ih阳性)的放电率,并被GABA受体拮抗剂微毒素所消除(PTX)。这些结果表明,ACCGlu投射通过VTA局部GABA能中间神经元抑制VTADA神经元的活性。
为了验证VTADA神经元也可能支配ACC并影响皮层疼痛的调节,如图2a所示,作者将逆行示踪病毒注射到ACC中,观察到强烈的mCherry标记TH阳性神经元,SNI小鼠的兴奋性大大降低。图2b显示,92.9%的顺行病毒追踪ACC神经元(td番茄阳性)为谷氨酸能(GFP阳性),其中76.9%也被标记为逆行病毒(BFP阳性),这证实了VTADA–ACCGlu–VTA回路的结构连接。接着,我们从图2c看到,将化学发生激活与碳纤维电极(CFE)记录相结合,实现了ACC中DA释放的实时监测,显示SNI小鼠ACC切片中DA释放减少。图2d显示,氟哌啶醇是一种典型的DA2型受体拮抗剂(D2R)。在图2e的ACC切片中局部应用CNO可以消除这些mCherry阳性神经元的放电,而D2R处理完全消除了这种抑制作用。
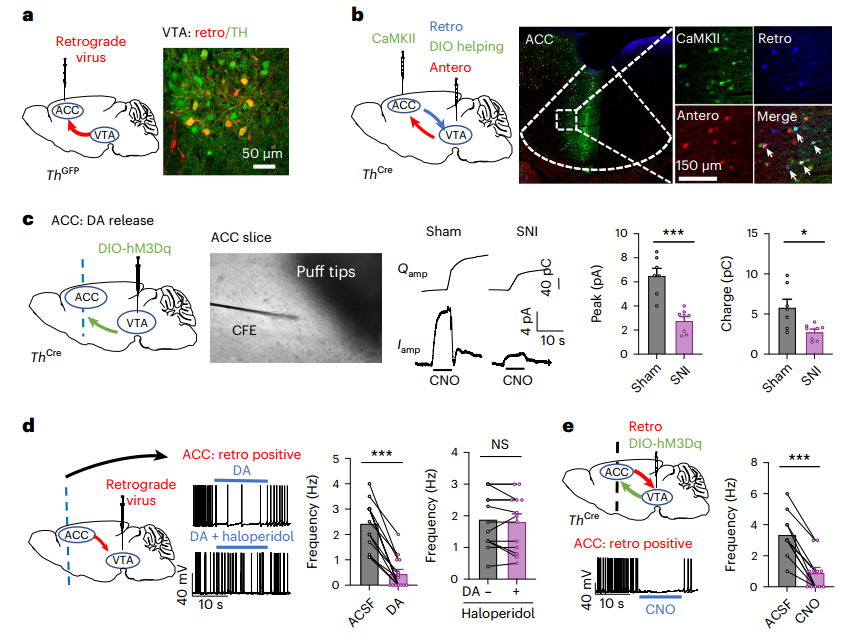
作者将表达Cre依赖性hM4Di的病毒注射到VTA中,如图2f所示,并在THCre小鼠的ACC中植入套管。抑制组在OFT、EPM和暗光盒(DLB)测试中表现出焦虑样行为。我们可以从图2h~i看到,它们对机械或热刺激的反应也有较低的伤害性阈值,并在条件性场所厌恶(CPA)测试中表现出厌恶行为。同样,我们可以从图2j~m看到,VTADA-ACC投射的化学发生激活完全恢复了SNI小鼠术后6周的疼痛超敏反应、焦虑样行为和厌恶行为。这些发现表明VTADA神经元也向VTA投射的ACCGlu神经元发送传入信号,以传递来自情绪变化的反馈信息。
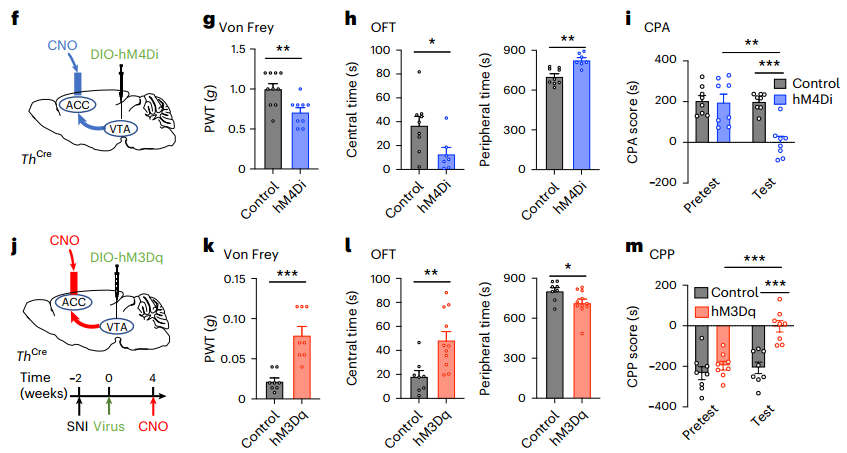
5.ACCGlu-VTAGABA-VTADA-ACCGlu形成一个正反馈回路
此时,作者大胆假设ACC-VTA-ACC回路是一个重叠疼痛感觉和情绪障碍的正反馈回路。VTA中ACCGlu投射的化学发生激发确实降低了ACC投射的VTADA神经元的放电率。我们可以从图3a~b看到,ACC中VTADA投射的化学发生抑制增加了VTA投射的ACCGlu神经元的放电速率。mCherry阳性但GFP(顺行病毒)阴性的神经元与TH阳性的VTADA神经元共定位。图3c~f显示,ACC中逆行标记的DsRed(逆行病毒)阳性神经元被密集定位的Ch2R-mCherry纤维包围(TH阳性),并且被回路末端的Ch2R-mCherry纤维的光激活所消除。接下来,我们从图3g看到,与假手术小鼠相比,CNO应用进一步增加了它们的Ca2+信号(SSCS)放电频率,但促进率降低。同样,图3h~j显示,VTADA终端的光遗传学抑制在VTA-突出的ACCGlu神经元中诱导了强大的Ca2+信号,6周后SNI小鼠的Ca2+信号减少。重要的是,我们可以从图3k~n看到,ACC中ACCGlu神经支配的VTADA终端的光遗传学激活大大缓解了SNI诱导的痛觉过敏和焦虑样行为。这些发现证明了ACC-VTA-ACC正反馈回路在维持持续疼痛和共病情绪变化中的关键作用。
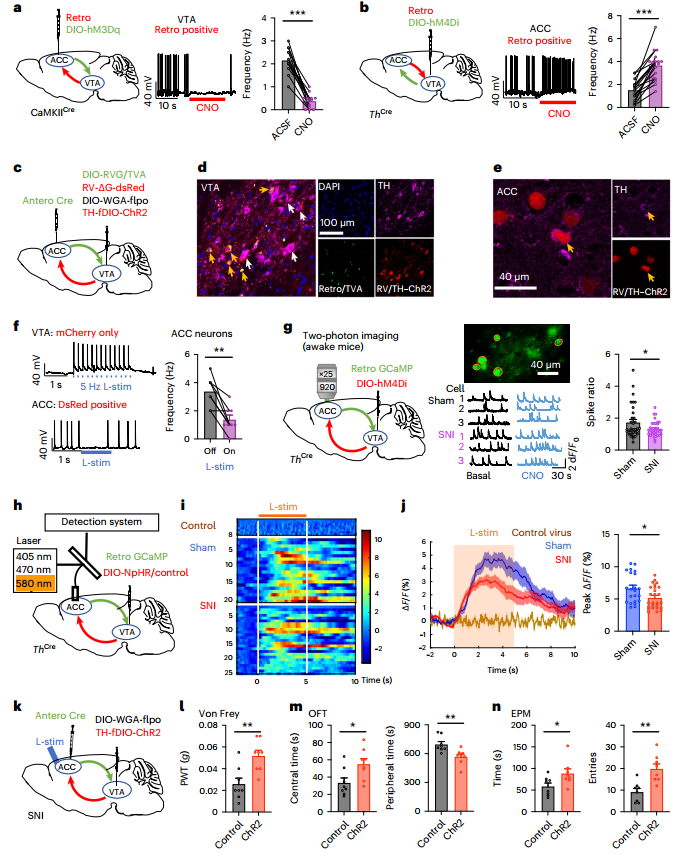
6.ACC-VTA-ACC反馈回路介导神经性疼痛的持续
接着,作者提出假设:重复的伤害性输入诱发ACCGlu神经元的过度活跃,从而激活ACCGlu-VTAGABA-VTADA-ACCGlu回路,通过回路内正反馈机制导致行为痛觉过敏的持续和强化。为了验证这一假设,如图4a所示,作者将表达Cre依赖的hM3dq病毒注射到ACC中,每天将雷酸盐局部传递到VTA(ACCGlu末端的激活),持续一周,以模拟长时间的伤害性输入。图4b~d显示,化学发生激活确实诱导了机械性伤害知觉阈值的降低,并导致了类似焦虑的行为,VTADA神经元的放电率下降,这持续了3周以上。重复的VTADA-ACC投射的化学发生抑制导致痛觉过敏和焦虑样行为,如图4e~h所示,ACCGlu神经元的放电速率增加,停止CNO应用后至少持续3周。这些发现表明,通过激活ACCGlu-VTA投射或抑制VTADA-ACC投射来调节ACCGlu-VTAGABA-VTADA-ACCGlu反馈回路足以诱导疼痛超敏感和焦虑样行为的长期持续,表明这种正反馈回路在持续疼痛的进展中起关键作用。
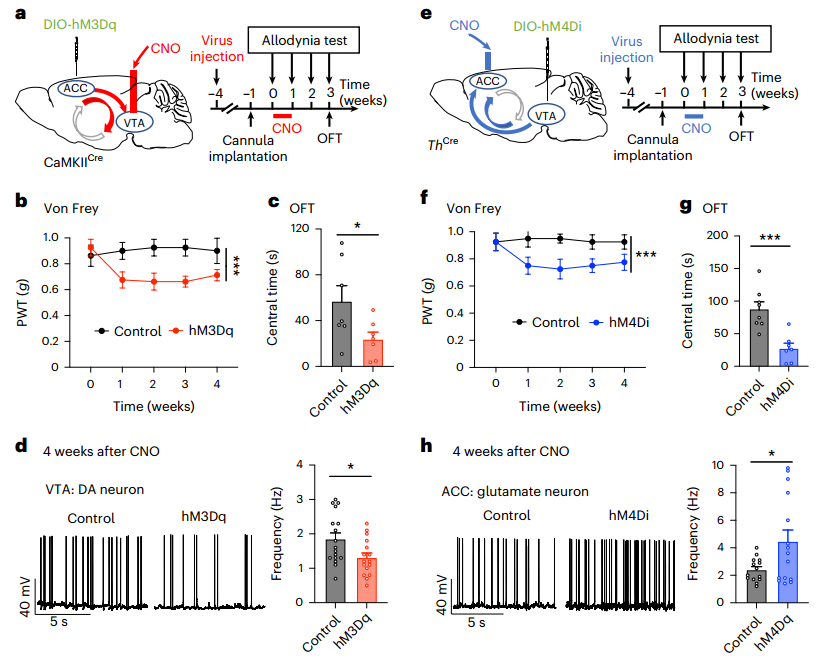
7.靶向ACC-VTA-ACC环内交叉点可缓解持续性疼痛
接着,我们可以从图5a~b看到,ACC中VTADA投射的化学激活不仅改善情绪状态,而且疼痛感觉缓解,并逐渐显现疗效。同样,我们可以从图5c~d看到,对ACCGlu-VTA投射的抑制促进了情绪状态,并对SNI小鼠的疼痛感觉显示出进行性疗效。图5f显示,在VTA重复应用CNO后,有效地恢复了hM4Di表达小鼠的SNI机械疼痛,撤销CNO应用后,至少维持了2周。同样,图5h~i显示,SNI小鼠的焦虑样行为在CNO应用3周后仍然完全恢复,这证实了ACC-VTA抑制对持续疼痛和共病情绪后果的长期疗效。图5g~i显示,ACC中VTADA投影的重复激活也导致SNI小鼠的机械反应以及焦虑样行为的渐进和持久恢复。这些发现确定了ACCGlu-VTAGABA-VTADA-ACCGlu正反馈回路作为长期缓解慢性疼痛的有效治疗靶点。
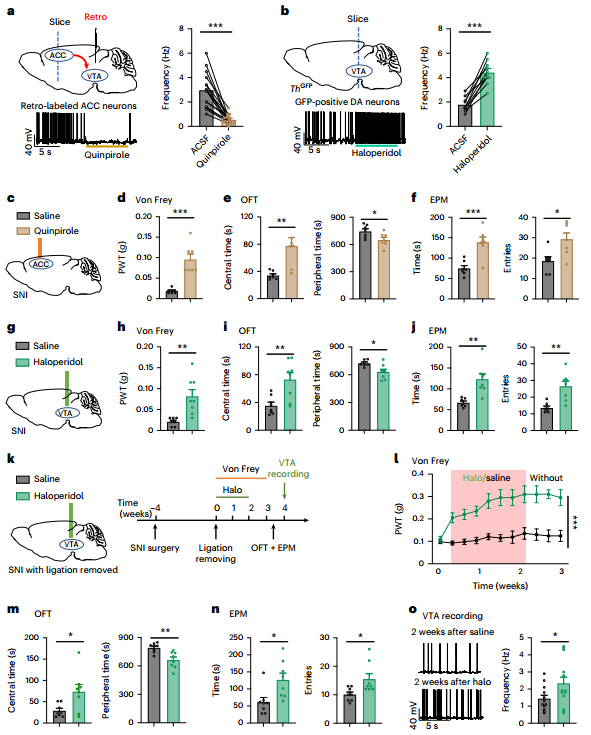
由于VTADA神经元在调节疼痛感觉和情绪后果之间的串扰和相互促进中起着核心作用,作者随后研究了DA在ACC中传递的干预是否对持续性疼痛有疗效。我们可以从图6a~f看到,局部应用喹匹罗(D2R激动剂)在ACC中模拟VTADA-ACC传播不仅缓解了SNI小鼠的机械痛,还缓解了共病的焦虑样行为。图6h~j显示,应用D2R后,SNI小鼠的亢进和疼痛性焦虑均明显减弱。图6k~n显示,在VTA中重复应用D2R对SNI诱导的持续性痛觉过敏和类焦虑行为具有进行性疗效。这些结果表明,拮抗VTADA神经元突触前D2R对持续性疼痛和共病情绪变化具有持久的疗效。
四、研究小结
本研究确定了ACC和VTA之间的相互神经元回路,该回路介导痛觉亢进和异动症之间的相互加剧及其情绪后果,从而介导神经病理性疼痛的慢性化。投射到VTA的ACCGlu通过激活局部VTAGABA间接抑制VTADA,这种效应在神经损伤后得到加强。VTADA神经元反过来投射到ACC,并与最初的ACCGlu神经元通过突触传递情绪变化的反馈信息。因此,ACCGlu-VTAGABA-VTADA-ACCGlu正反馈回路介导了持续性疼痛和合并焦虑抑郁样行为的发展和维持。最终在神经病理性疼痛的小鼠模型中发现,中断这一反馈回路可以缓解急性和长期的痛觉亢进和焦虑抑郁样行为。
五、国自然中标情况














 文章推荐
文章推荐