
活性氧(ROS)是一种极具反应性的物质,能够破坏脂质、蛋白质、DNA等细胞成分,最终导致细胞功能障碍和死亡。在氧化应激状态下,ROS的产生与机体通过抗氧化防御机制对其进行抵消的能力之间失去了平衡。那么关于氧化应激有什么课题设计思路呢?今天我们一起来探讨一下。
接下来我们将分享一篇发表于中科院1区期刊Journal of Extracellular Vesicles,影响因子为15.5的文献,希望能给大家带来不一样的灵感。
一、文章信息

【文章题目】:神经酰胺介导的氧化应激响应通过伪足衍生的小型细胞外囊泡进行调控
【发表期刊】:Journal of Extracellular Vesicles
【影响因子】:15.5/中科院1区
二、研究背景
①细胞外囊泡(Extracellular Vesicles, EVs)是细胞释放的膜结构小囊泡,参与多种生物学过程;
②氧化应激是细胞损伤和疾病发生的一个重要因素,它可以诱导细胞产生EVs;
③在细胞生物学领域,神经酰胺作为一种重要的生物活性脂质,在细胞信号传导、细胞死亡以及细胞形态变化中扮演着关键角色;
④中性鞘磷脂酶2(nSMase2)和酸性鞘磷脂酶(ASM)在细胞膜上催化鞘磷脂水解生成神经酰胺,影响细胞膜的流动性和曲率,从而参与调节EVs的形成;
⑤氧化应激条件下,nSMase2和ASM的活性增加,促进神经酰胺的生成,这可能与EVs的生物生成和分泌密切相关。
三、技术路线
四、研究结果
1.氧化应激诱导丝状足的形成和丝状足衍生EV的分泌
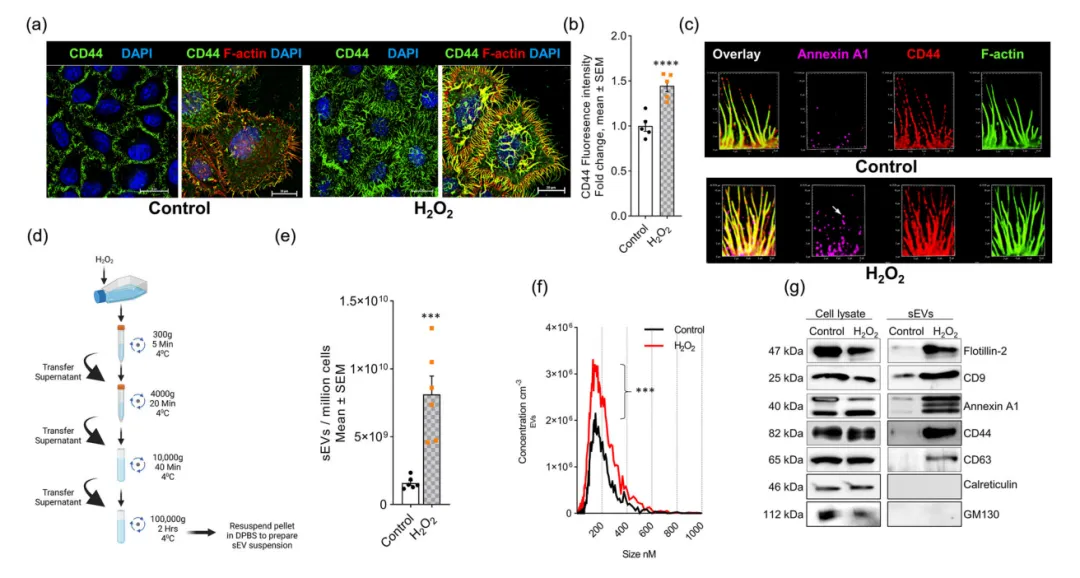
为了明确氧化应激如何对EVs分泌产生影响,他们进行了相关研究,发现H2O2处理的Hela细胞显示出CD44标记的伪足数量及Annexin A1增加,表明氧化应激通过丝状伪足的质膜出芽导致EVs脱落(图1a~c)。随后通过差示超离心从培养基上清中制备小型sEV,并进行纳米粒子跟踪分析(NTA),结果表明,H2O2使sEV的数量增加了至少5倍(图1d~e),但没有改变sEV的中等大小(图1f),表明氧化应激增加了sEV。WB结果显示Annexin A1、CD9等标记蛋白出现,但是Calreticulin和GM130这两种内质网和高尔基源性微体囊泡的标记物可能因细胞裂解而释放,而没有出现(图1g)。从上面这些研究结果总结得出,氧化应激促进了伪足衍生的sEVs的分泌。
2.SMases生成神经酰胺对氧化应激诱导的sEV分泌至关重要
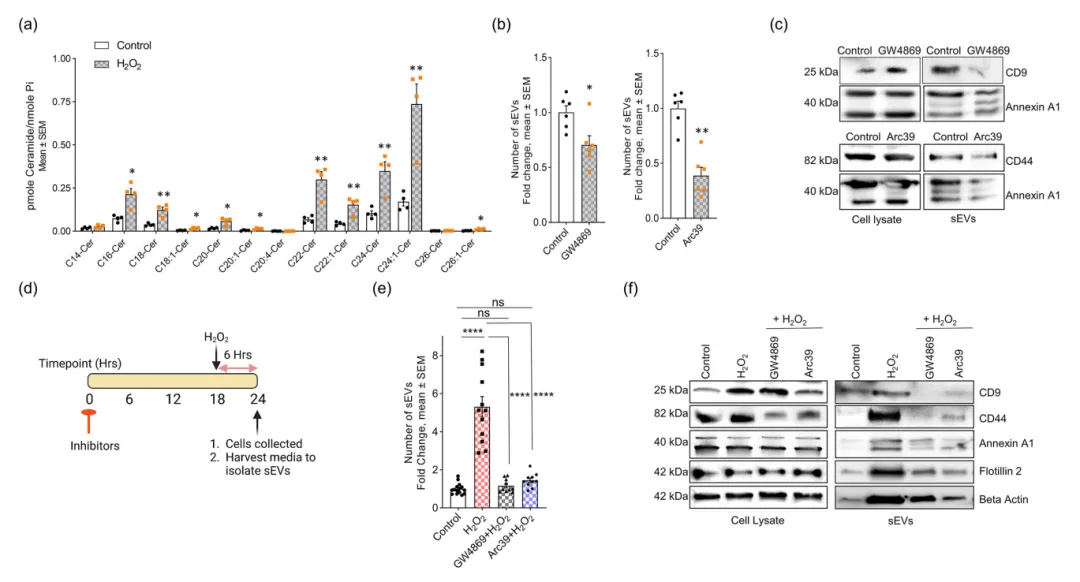
由于氧化应激条件下,还存在nSMase2和ASM的活性增加,促进了神经酰胺的生成,为了探究神经酰胺在sEV分泌过程中的作用,研究者使用了靶向质谱/脂质组学分析,发现在H2O2处理后,sEVs和细胞裂解液中大多数神经酰胺种类的水平显著增加(图2a),表明sEVs的神经酰胺富集依赖于质膜上神经酰胺的局部生成,可能是通过SMases激活。使用SMase抑制剂GW4869和Arc39处理的Hela细胞,减少了sEV的生成数量,sEV中CD9、Annexin A1和CD44的减少证实了这一点(图2b~c)。GW4869和Arc39完全阻断H2O2处理的Hela细胞sEV分泌的增加,说明nSMase2和ASM在氧化应激诱导的sEV分泌中起着至关重要的作用(图2d~e)。与未用H2O2处理的细胞类似,SMase抑制剂降低了sEV中微囊泡和丝状足的标记物(图2c,f)。这进一步表明丝状足神经酰胺的产生对sEV的分泌至关重要。
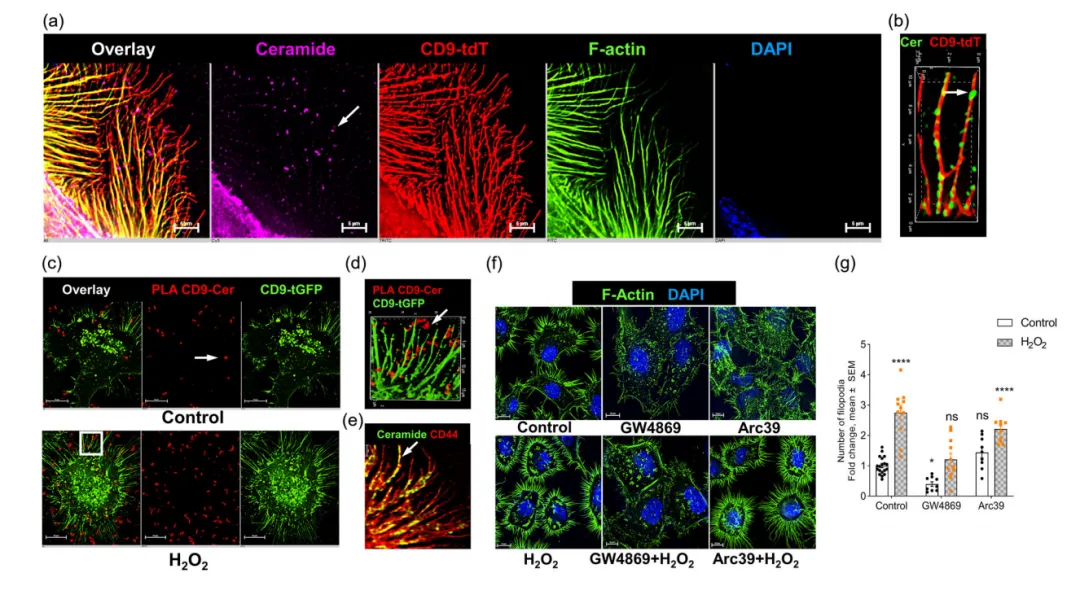
在随后的免疫荧光结果中,神经酰胺以点状标记出现,表明沿丝状足有萌发的新生囊泡(图3a)。接近结联实验(PLA)说明,在过表达CD9结合GFP的Hela细胞中,神经酰胺与CD9在丝状足处相互作用,H2O2增加了CD9(图3c~d)。还发现CD44标记的丝状足与神经酰胺共标记(图3e)。F-actin荧光标记结果显示,单独使用GW4869可减少丝状足的形成,而单独使用Arc39不影响丝状足的形成,H2O2增加丝状足的形成,GW4869能阻止丝状足的形成,而Arc39不能(图3f)。与CD44标记的结果一致,H2O2增加了未处理和H2O2处理的细胞的丝足数量,而GW4869减少了丝足数量(图3g)。上述结果说明,nSMase2对丝状足的形成和sEV的分泌都是至关重要的,而ASM仅对sEV的分泌是必需的。
3.nSMase2定位于丝状足的质膜时发生S-棕榈酰化
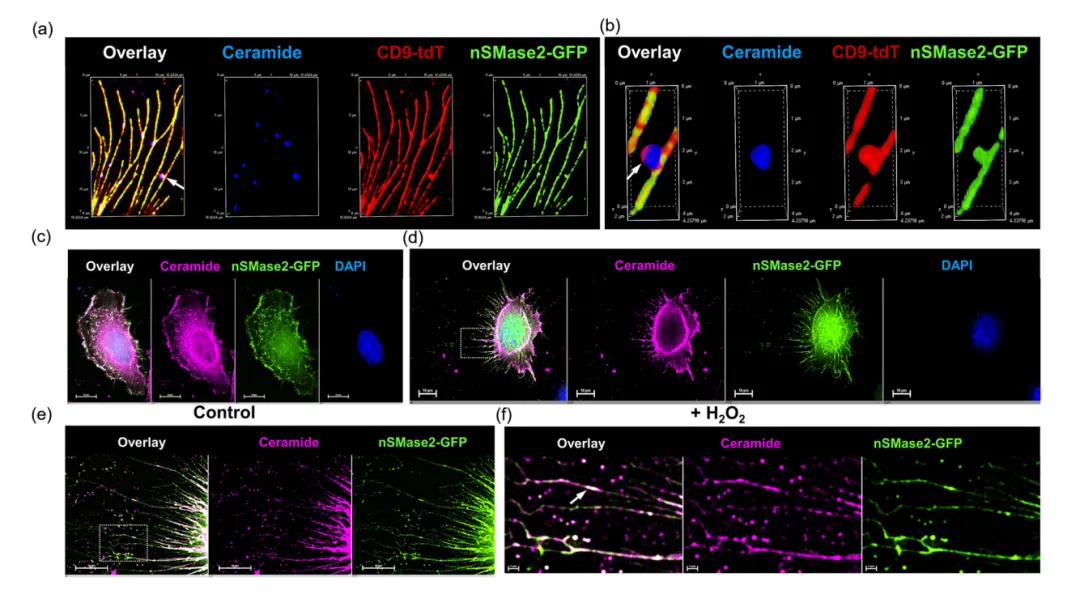
为了探究氧化应激是否诱导nSMase2定位于丝状伪足,研究者构建了一个编码野生型nSMase2的质粒,在其C端与GFP融合。CD9-tdT和WTnSMase2-GFP的共表达以及神经酰胺的免疫细胞化学表明,丝状足被CD9-tdT、WTnSMase2GFP和神经酰胺共同标记(图4a)。用抗神经酰胺兔IgG对神经酰胺进行点状标记,丝状足部显示膜芽,同时标记CD9-tdT和/或nSMase-GFP(图4b~c)。结果显示,H2O2培养增加了WTnSMase2-GFP/神经酰胺标记的丝状伪足和膜芽的数量,与氧化应激诱导的丝状伪足形成和丝状伪足起源的sEV一致(图4d~f)。
研究表明,两段半胱氨酸残基对于nSMase2的s-棕榈酰化及其在质膜上的定位至关重要。因此使用NBD-神经酰胺标记的sEVs来追踪神经酰胺在受体细胞中的运输和定位。结果表明,在棕榈酰叠氮中,质膜和细胞质囊泡中的蛋白质发生了强烈的s-棕榈酰化,然而,只有表达WTnSMase2-GFP的细胞显示PLA信号(图5a~c)。在这些细胞中,PLA信号主要与丝状足中的nSMase2-gfp共定位(图5d,箭头),表明nSMase2定位在丝状足中时被s-棕榈酰化。与WTnSMase2-GFP相比,nSMase2-GFP(3A5A)主要定位于细胞质中的囊泡,这些囊泡被溶酶体标记蛋白Lamp1共同标记(图5e)。综上,氧化应激诱导的富含神经酰胺的sEV分泌涉及丝状足中另一种产生神经酰胺的酶。
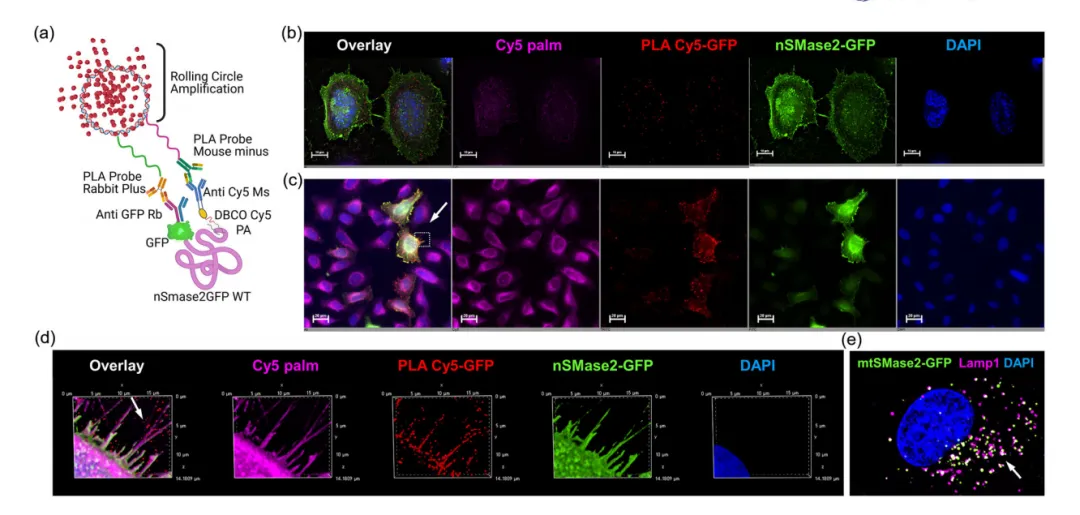
4.ASM和nSMase2在丝状足中相互作用,诱导分泌富含神经酰胺的sEV
为了进一步探究ASM影响sEV的分泌的作用机制,通过ASM的免疫细胞化学表明H2O2诱导溶酶体ASM激活并易位到质膜外小叶,从而产生局部的富神经酰胺平台(图6a)。有趣的是,ASM-gfp、nSMase2和神经酰胺共定位于丝状足的点状位点(图6b),表明ASM和nSMase2可能在丝状足的局部神经酰胺生成中协同作用。PLA实验显示,使用H2O2处理后,并置的ASM和nSMase2的PLA信号数量增加了2.5倍(图6d~e),并且信号与丝状足中的神经酰胺共定位(图6f~g),表明氧化应激导致ASM和nSMase2在丝状足中产生神经酰胺的功能相互作用。而H2O2处理导致sEVs结合的ASM和nSMase2的分泌,同时降低了这两种酶的细胞水平和活性。sEVs结合的ASM免疫印迹显示在70和55kDa处有两条蛋白带(图6h~i),表明sEVs同时含有ASM的分泌和溶酶体形式。综上,氧化应激诱导的ASM和nSMase2相互作用导致丝状足局部产生神经酰胺,随后分泌富含神经酰胺的sEVs,这些sEVs携带ASM和nSMase2。
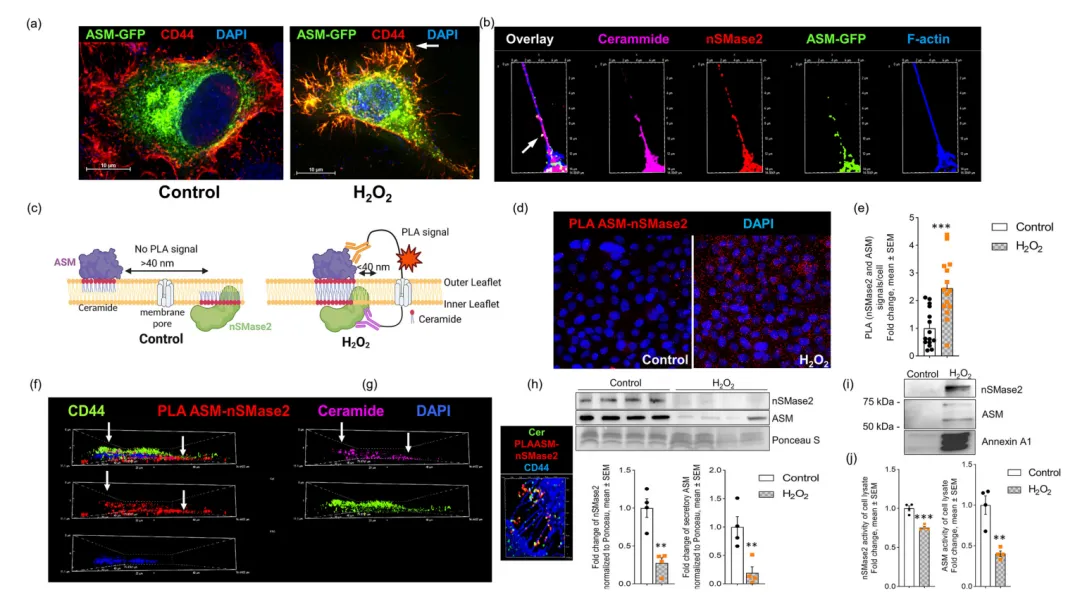
5.氧化应激诱导的sEV将神经酰胺转运到线粒体并诱导细胞死亡
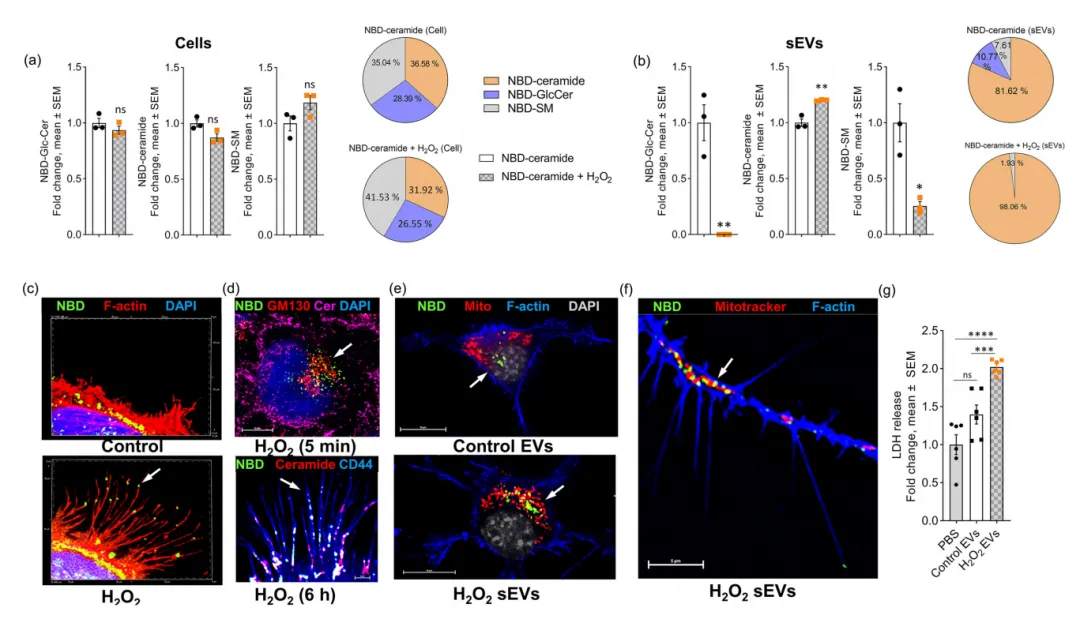
随后,研究人员开发了一种新的EV标记协议,使用荧光标记的NBD-神经酰胺处理供体细胞,并在有无H2O2的情况下追踪sEVs,以明确氧化应激诱导的sEVs对神经酰胺的调控作用。HPLC结果显示,细胞将2/3的NBD-神经酰胺转化为其衍生物,但H2O2对NBD-神经酰胺代谢没有显著影响。然而,NBD-神经酰胺补充细胞分泌的sEV含有80%以上的NBD-神经酰胺,H2O2进一步将其增加到98%(图7a),与图7b的sEVs质谱分析结果一致。NBD荧光信号与丝状足中免疫标记的神经酰胺和CD44共定位(图7d),表明它们标记了膜区域,产生了富含NBD神经酰胺的sEVs。H2O2培养的Hela细胞的sEVs也被带入N2a细胞,且很大一部分NBD-神经酰胺信号与线粒体共定位(图7e)。用H2O2诱导的sEVs孵育的N2a细胞的LDH释放量显著增加,而用PBS或对照sEVs孵育的N2a细胞的细胞死亡明显减少(图7g)。综上,氧化应激诱导的sEVs被转运到线粒体并诱导神经元细胞死亡。
五、研究小结
综上所述,在非应激细胞中,由于质膜神经酰胺水平较低,sEV的基线脱落较低。在氧化应激细胞中,nSMase2和ASM在质膜上的定位和排列增加,导致富含神经酰胺的sEV的丝状伪足形成和脱落增加。GW4869抑制nSMase2可减少丝状足的形成和sEV的脱落,而抑制ASM仅能减少sEV的脱落。
六、国自然中标情况

 文章推荐
文章推荐