
科学研究方案设计时,除了要具有创新性和可行性,还要紧靠当前的研究热点!今天我们一起来共同学习关于“坏死性凋亡”这一热点的基本知识,以及它相关的研究思路~
一、坏死性凋亡、焦亡与凋亡
坏死性凋亡:坏死性凋亡与凋亡的区别主要在于膜完整性丧失,内容物外泄。坏死是由死亡结构域受体(如TNFR和Fas)和toll样受体TLR4或TLR3触发的。激活后,这些受体招募连接蛋白FADD、TRADD和TRIF,它们与RIPK1和caspase-8或-10相互作用。
焦亡:当信号通过炎症小体传感器NLRP3时,NLRP3在接收到刺激后被激活,继而招募适配器ASC,形成称为炎症小体的微米级结构。这些炎症小体可以去切割caspase-1前体,引导下游炎症因子的释放。

除此之外,切割后的caspase-1可以直接作用于GSDMD,形成N末端片段,使细胞膜上形成孔膜,导致内容物流出;或者切割成小分子的炎症小体——IL-1、IL-2和IL-18,细胞内炎症小体逐渐增多,使得细胞膨胀破裂,细胞内容物流出。
GBP家族可以与细菌表面发生结合。此外,LPS的细胞内识别可导致焦亡:鸟苷酸结合蛋白(GBPs)与细菌表面结合并组装由GBP4、11、1和2组成的caspase-3/4激活平台,以及caspase-4和caspase-11的胞质前体。活性caspase-4和caspase-11切割GSDMD,导致焦亡。
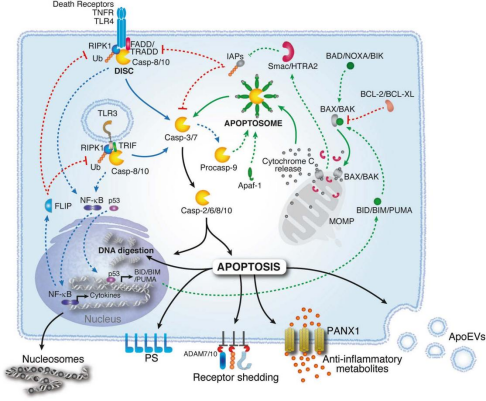
凋亡:如图所示,凋亡的途径主要分为内途径和外途径。
二、坏死性凋亡与肿瘤的进展
下面这篇高分文献主要介绍了坏死性凋亡与肿瘤的进展。

RIPK3作为坏死性凋亡的中心因子,可以通过甲基化或去甲基化,发生促癌或者抑癌作用。
根据数据库显示,RIPK3在大多数实体瘤细胞中,表达是下调的,而在液体瘤细胞中,表达则是上调的。

化疗和放疗诱导的急性坏死性下垂通过抗原呈递树突状细胞(DCs)和T细胞之间的交叉引发促进肿瘤抗原识别。活化的细胞毒性T细胞浸润促进肿瘤消退。
在晚期肿瘤中,坏死因子途径通过调节淋巴细胞和肿瘤相关巨噬细胞(TAMs)产生免疫抑制肿瘤微环境,从而促进肿瘤生长。癌细胞坏死是肿瘤坏死的主要原因,肿瘤坏死与免疫抑制、血管生成和转移的增加有关。同时,由肿瘤细胞分泌的死亡受体配体触发的坏死性凋亡可能促进循环肿瘤细胞(CTC)的外渗。
三、案例分享
在对细胞坏死性凋亡的概念有一定了解后,我们通过一篇高分文章,来一起了解坏死性凋亡在疾病中的具体应用。


文章研究思路
这一研究最终得出结论:转录因子ATF3在雄性小鼠肝脂肪变性这种疾病中,可以将细胞从凋亡转化成坏死。
以上就是关于细胞坏死性凋亡的课程分享~
 文章推荐
文章推荐