
蛋白质作为生命功能的主要执行物质,其功能研究一直备受青睐,而蛋白质翻译后修饰作为调节蛋白质生物学功能的关键步骤之一,也成为了众多科研人的聚焦点。
近年,泛素化相关文章发表量逐年上升。今天我们就给大家介绍一下泛素化的基本概念,并结合案例分享研究思路,最后给大家简单介绍一下相关的实验技能。
一、什么是泛素化
泛素化是蛋白质翻译后修饰的一种形式,其过程包括蛋白酶体的蛋白质降解、细胞周期进程、转录调控、DNA修复和信号转导。泛素通过其C末端与赖氨酸的ε-氨基共价连接,或(较少)与蛋白质的N末端形成肽键。
泛素化的发生需要以下三种酶的连续作用:
1.泛素激活酶(E1)催化泛素的ATP依赖性活化,并在泛素C末端和半胱氨酸之间形成硫酯键;
2.泛素被转移到泛素缀合酶(E2s)催化的半胱氨酸中;
3.最后,泛素通过泛素连接酶(E3)转移到底物上。
其中,E3是泛素化途径中最异质的一类酶,它们介导的底物具有特异性。目前,根据特征结构域的存在和泛素转移到底物蛋白的机制,可以将E3连接酶分为三种类型:
类型1:RING E3s
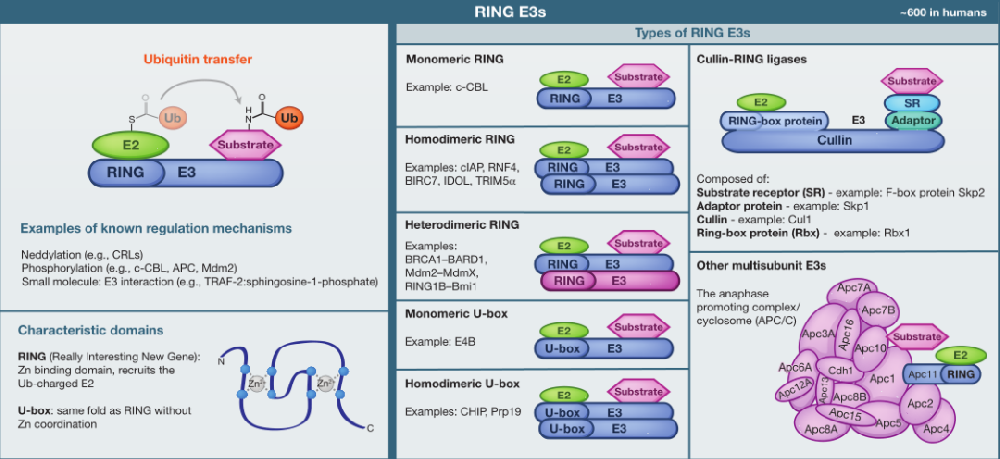
这是最丰富的一类泛素连接酶,它们拥有一个锌结合结构域,或是一个U-box结构域,该结构域具有相同的环褶皱,但不含锌。环和U-box结构域负责结合E2和刺激泛素转移。
类型2:HECT E3s
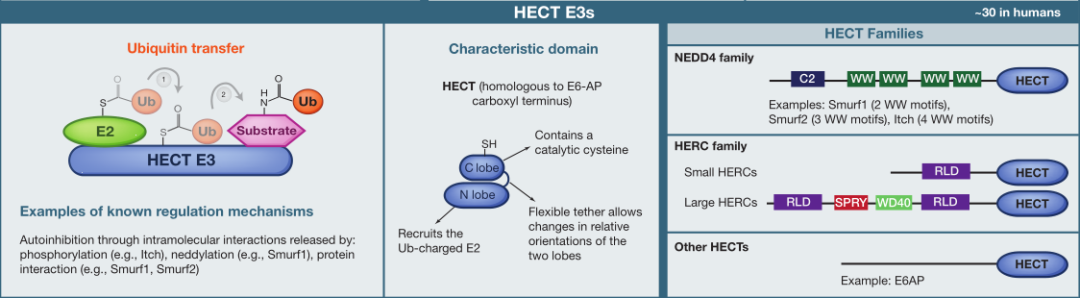
HECT与E6AP羧基末端同源,其结构域家族的E3连接酶通过2步反应催化,转移到底物蛋白:首先将泛素转移至E3上的催化半胱氨酸,然后从E3转移到底物。
类型3:RBR E3s
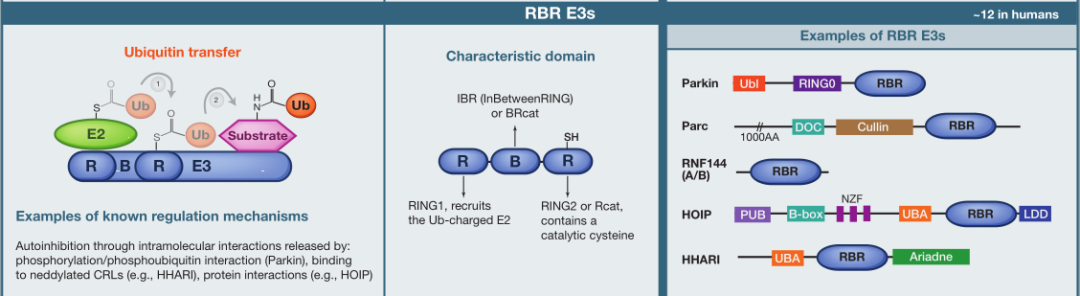
与HECT E3s类似,RBR E3连接酶通过2步反应催化转移到底物蛋白:首先将泛素转移至E3上的催化半胱氨酸,然后从E3转移到底物。
RBR E3连接酶包含特定于每个成员的额外结构域,结构域参与分子内相互作用,使蛋白质处于自身抑制状态。而这种状态可以通过各种机制释放,如磷酸化或蛋白质-蛋白质相互作用。
在对泛素化有了一定的了解后,接下来就和我们一起结合高分文章,学习如何将泛素化结合到我们的研究当中。
二、案例分析

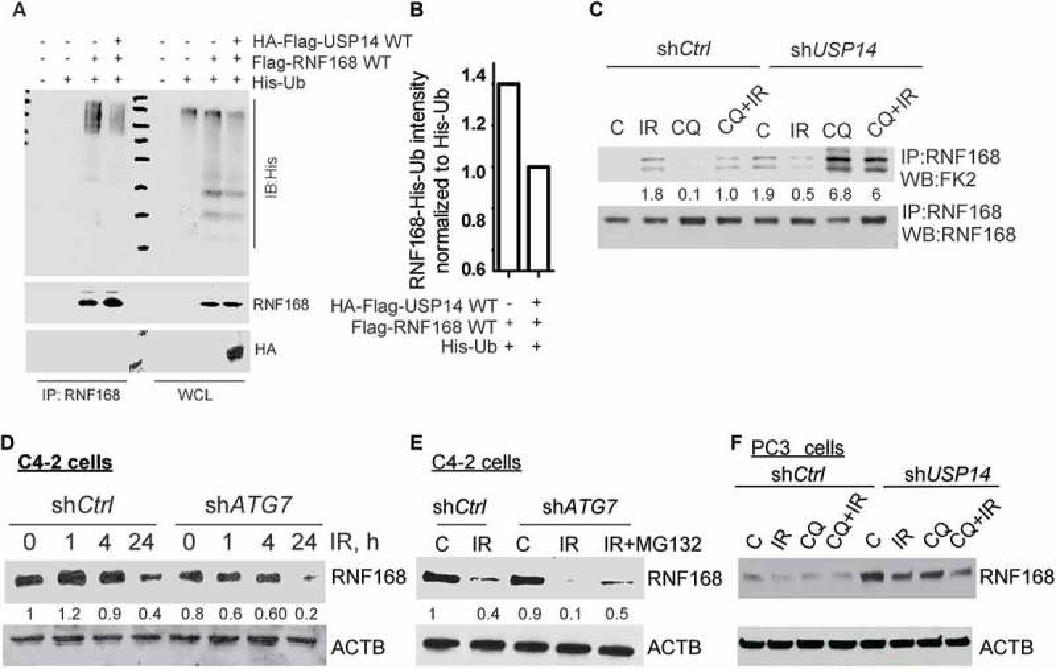
本文作者主要研究泛素化在自噬中与DDR信号串扰之间的相互作用。
IR治疗可以激活许多肿瘤自噬,而组蛋白H2A和H2AFX/H2AX响应的DNA DSBs泛素化是一种关键的翻译后修饰,具有介导下游信号传导,DNA修复因子募集的作用。因此,作者认为泛素化和去泛素化信号可以有效动态调节DDR。
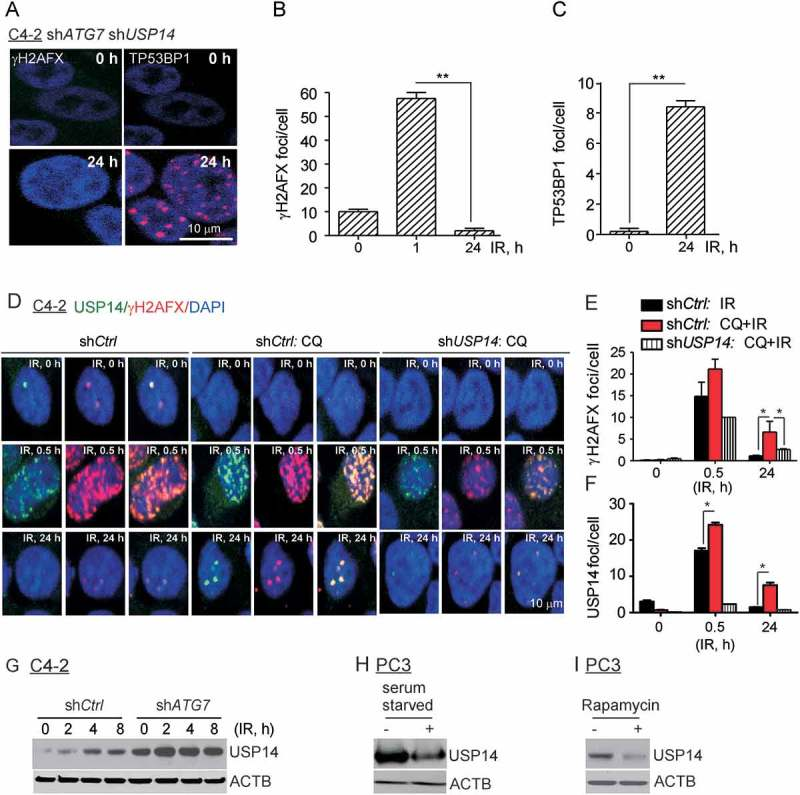
1、前列腺癌细胞中自噬抑制能诱导DNA损伤
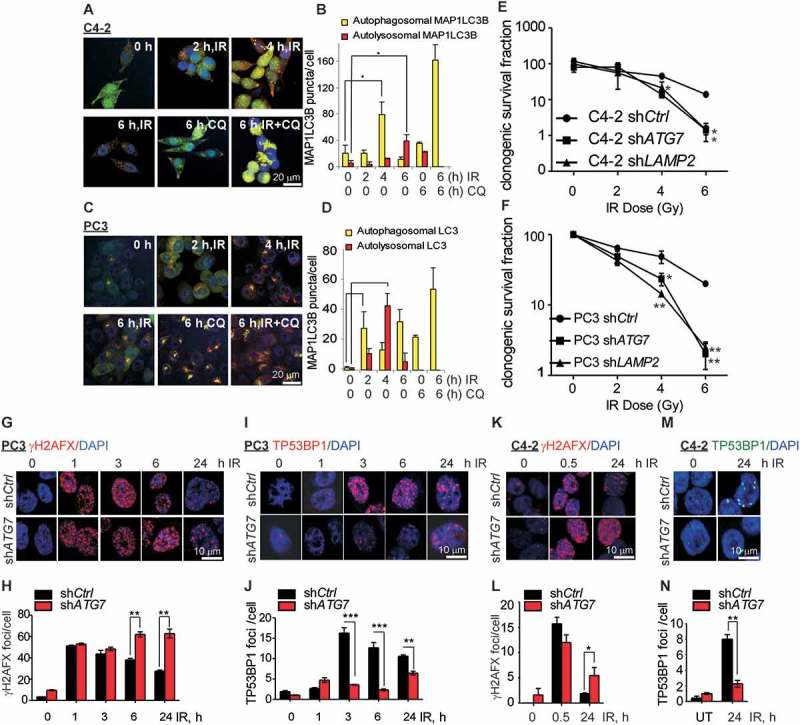
2、USP14破坏自噬缺陷细胞中的DDR信号传导
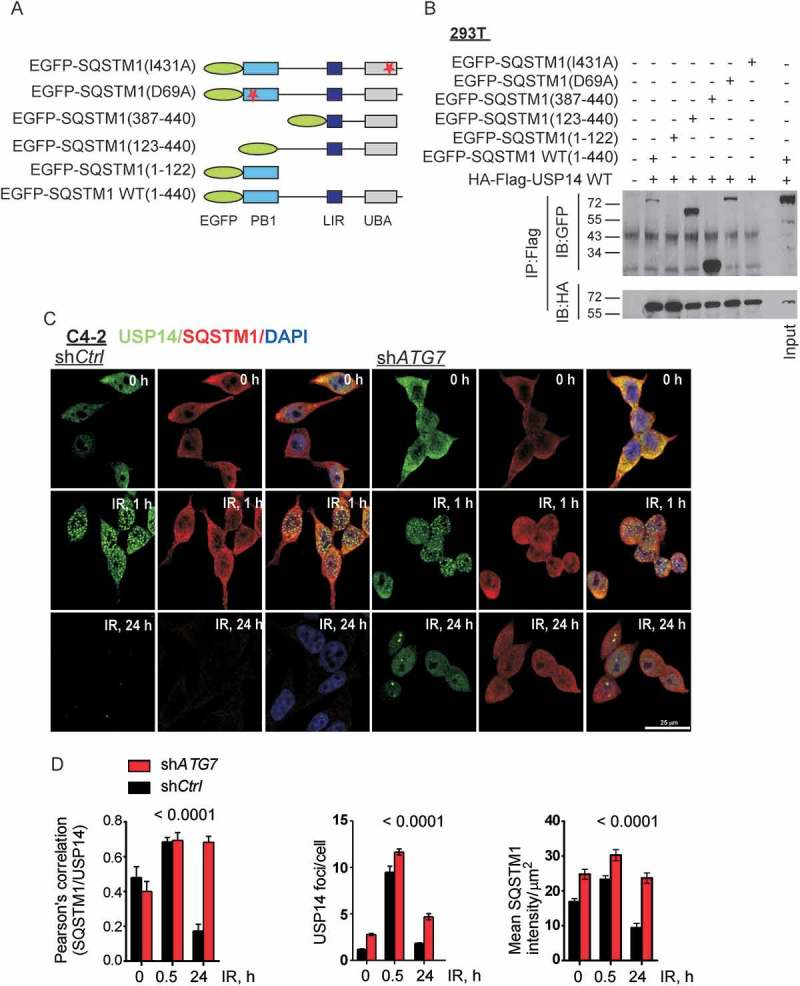
3、SQSTM1与USP14结合且调节其水平
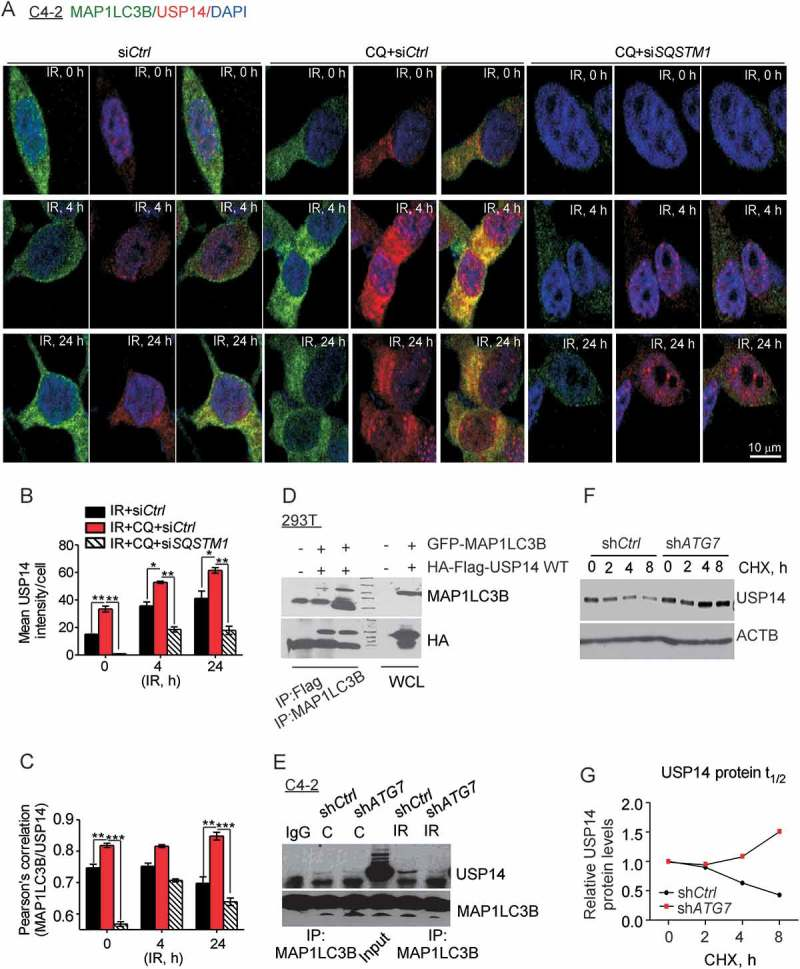
4、USP14是自噬底物
5、USP14介导RNF168泛素化
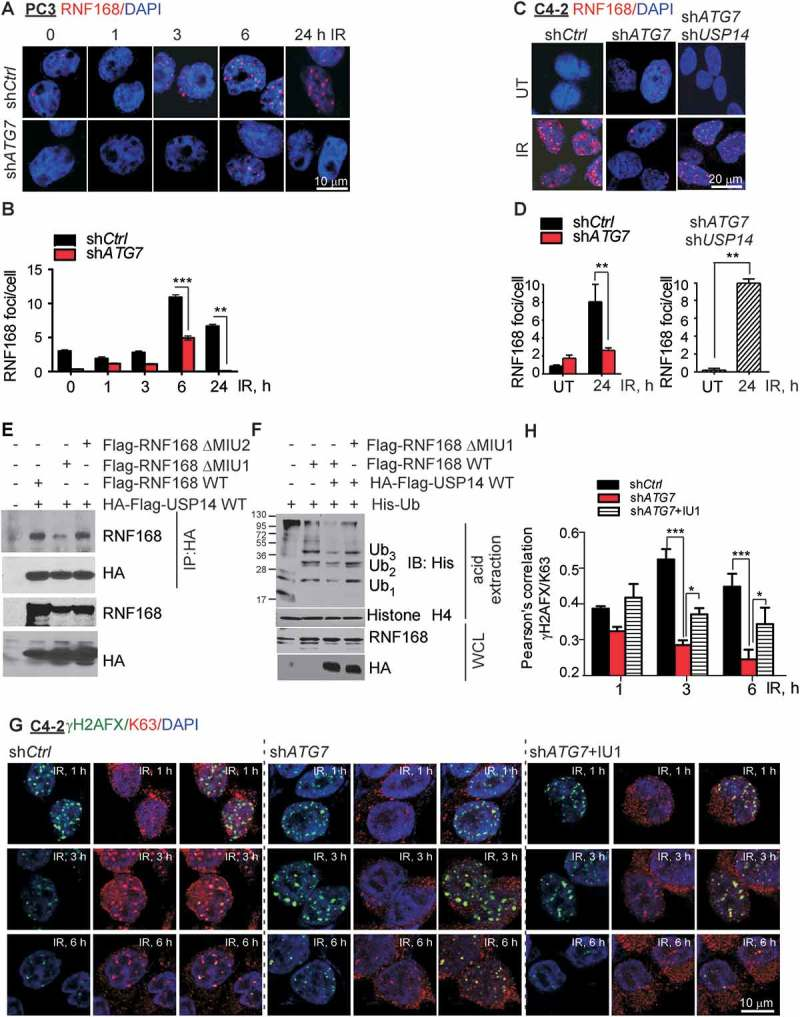
6、USP14调节RNF189的泛素化来影响其蛋白水平
三、相关实验技能
蛋白泛素化检测(IP-WB法):IP-WB法通过免疫共沉淀将目标蛋白与其结合的蛋白分离,将分离的蛋白再进行SDS电泳和Western Blot检测。
具体步骤:
(1)将目标蛋白真核表达载体和带HA tag的泛素载体共转染细胞(可以是所研究的细胞,也可以用工具细胞293T)
(2)24小时后加入20µM蛋白酶体抑制剂(MG-132),孵育4小时后收取细胞
(3)加入预冷的细胞裂解液(使用前加入PMSF和磷酸酶抑制剂),于冰上裂解30min
(4)4℃,12000转离心20min,提取上清蛋白至新的EP管中,加入1µg目标蛋白抗体,4℃缓慢摇至过夜
(5)加入20µl的Protein AG beads,继续4℃缓慢摇转4小时
(6)4℃,2500转离心5min,小心吸除上清,沉淀中加入1mlPBS洗涤,洗涤后,4℃,2500转离心5min,洗涤步骤重复3-5遍
(7)沉淀中20µl 1xSDS PAGE电泳上样缓冲液,Vortex轻微震荡重悬沉淀
(8)4℃瞬时高速离心将样品离心至管底,与沸水中煮沸10min
(9)上清进SDS PAGE电泳,用Western Blot检测泛素化情况(用HA标签抗体)
以上就是本篇文章的全部内容~
 文章推荐
文章推荐