
众所周知,细胞异质性是肿瘤研究和诊断治疗中亟待解决的关键问题,为了解决这一问题,单细胞测序技术应运而生。那么,单细胞测序是什么?它又是如何应用到实践中的?
一、什么是单细胞测序
单细胞测序技术是指在单个细胞水平上,对基因组、转录组、表观组进行高通量测序分析。这项技术主要有以下几个优点:
能解决样本量太少无法进行常规测序的问题
能解决细胞间异质性问题
有效避免PCR扩增偏好性问题
二、如何选择合适的方法
将CEL-seq2/C1、Drop-seq、MARS-seq、CSRB-seq、Smart-seq/C1、Smart-seq2六种常用的方法进行对比后,得出了以下结论,供大家参考:
01 Smart-seq2检测到最多的基因,灵敏度最好
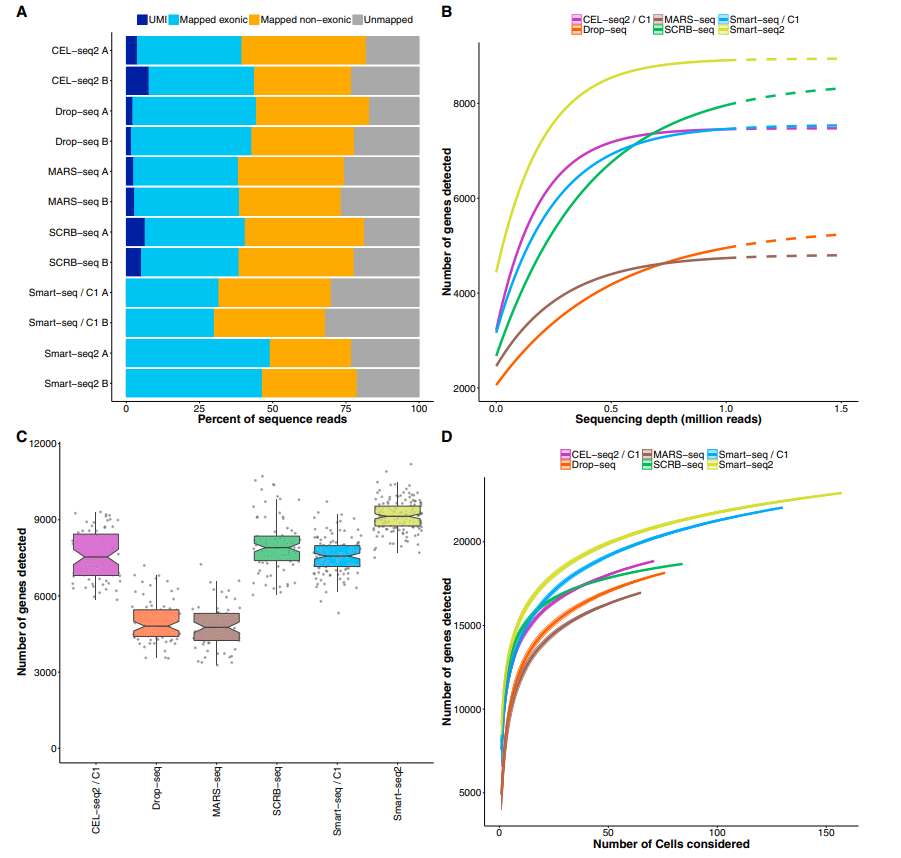
02 Drop-seq、Smart-seq2适用于测定细胞内基因绝对表达水平
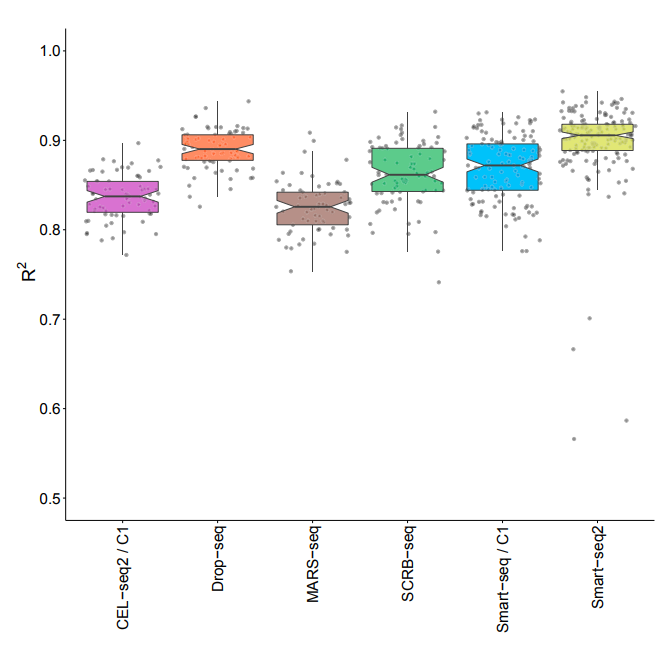
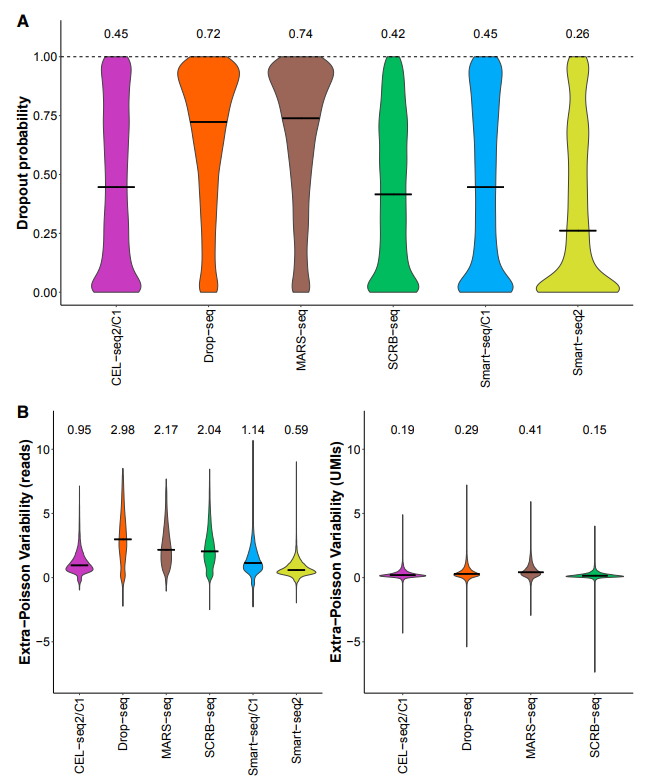
03 CEL-seq2、Drop-seq、MARS-seq和SCRB-seq由于使用了独特的分子标识符(UMI),能以较小的扩增噪声量化mRNA水平
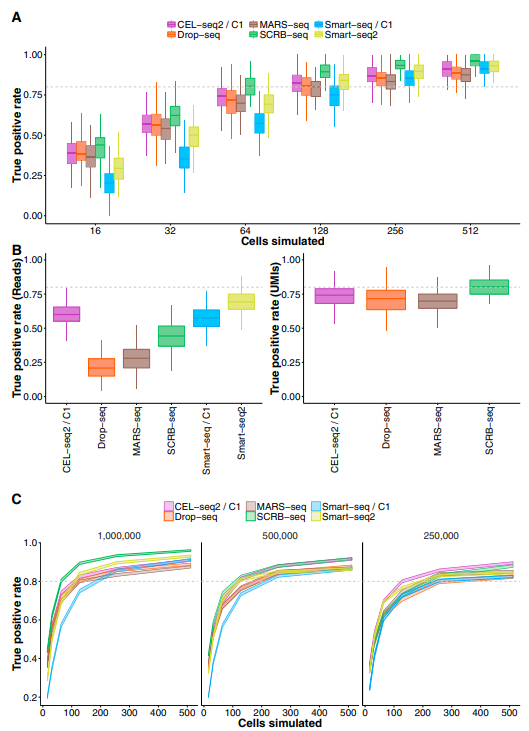
04 Drop-seq对于大量细胞的转录组定量更具成本效益,而MARS-seq、SCRB-seq和Smart-seq2在分析较少细胞时更有效
三、案例分析
接下来我们一起来阅读一篇新鲜出炉的文献,了解一下如何将单细胞RNA测序与我们的研究相结合。

这篇文章的题目是“扁桃体样本体外曝露于X4-tropic HIV-1NL-CI病毒”,作者利用来自健康的人类捐赠者的人扁桃体外植体,体外感染HIV-1病毒后,进行单细胞RNA测序来分析组织中所代表的细胞类型,并研究病毒感染对基因表达原蛋白和炎症信号通路的影响。
01 Step 1
首先,作者将扁桃体外植体暴露于艾滋病病毒八天后,通过FACS分析确定2.45%的活细胞被有效感染了艾滋病病毒。
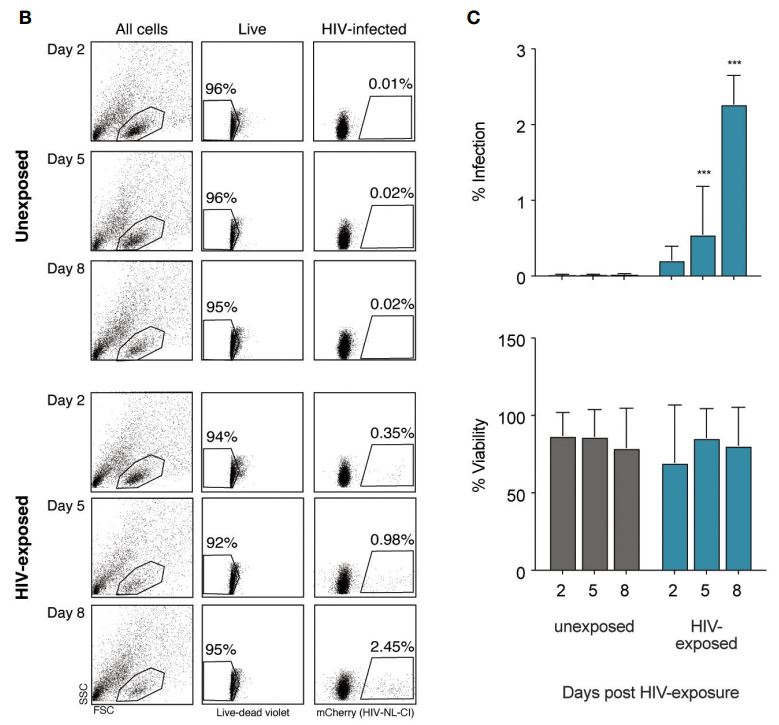
02 Step 2
随后作者进行单细胞RNA测序,从结果中可以看到主要细胞的分群以及细胞强表达基因的分布。
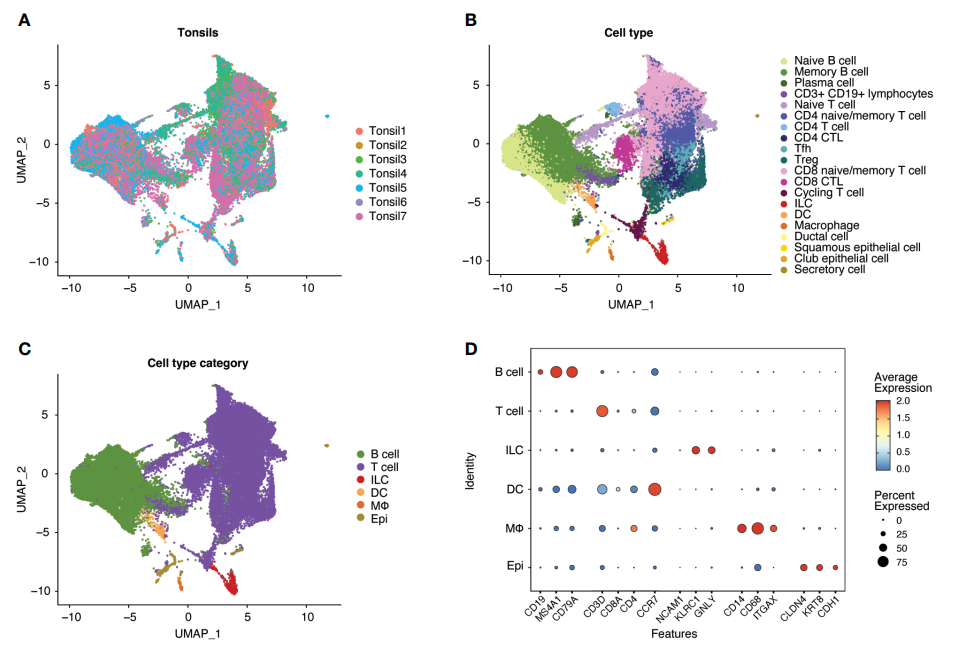
03 Step 3
接着作者过滤出已感染HIV的细胞分群。(下图A中mCherry阳性表示感染成功)
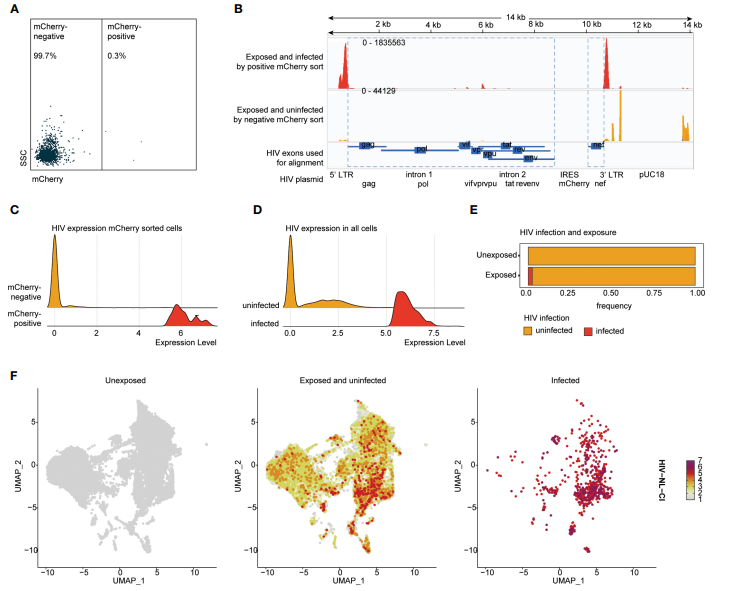
04 Step 4
作者将实验组分为HIV暴露与未暴露两组,并测定了暴露后感染与未感染细胞分群中各类细胞的占比。火山图显示了感染细胞和未感染细胞之间基因表达的倍数变化。
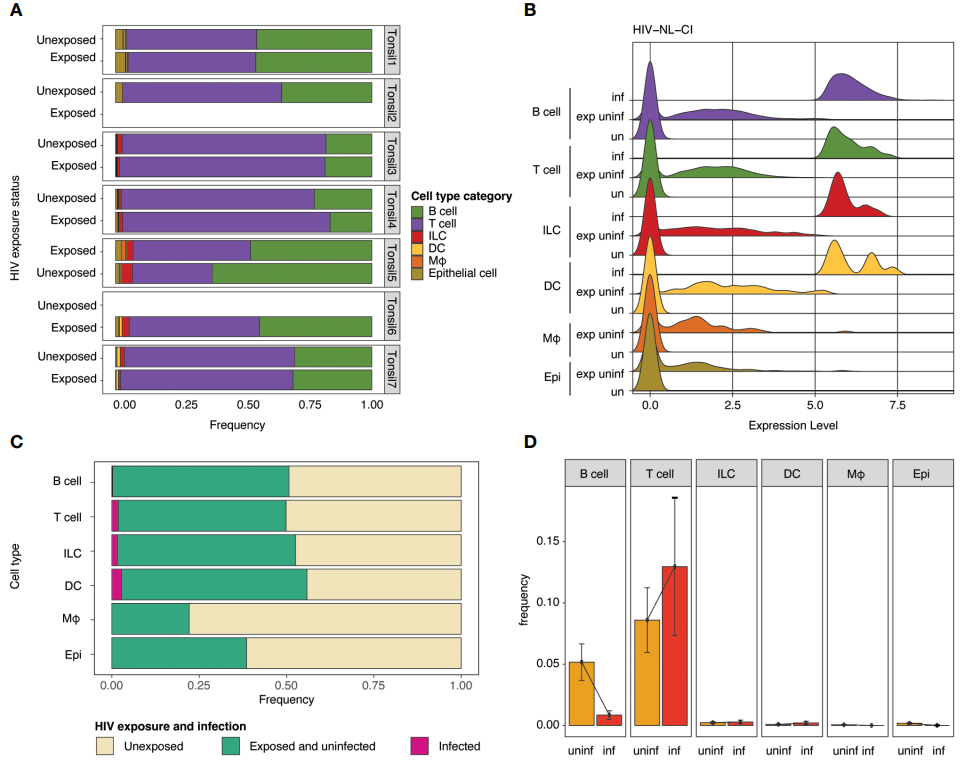
05 Step 5
为了进一步探讨HIV感染对基因表达差异的影响,作者对细胞类别进行探索。实验结果发现受感染T细胞与未暴露T细胞之间存在基因表达差异。与未感染T细胞相比,感染T细胞中基因表达有所增加。
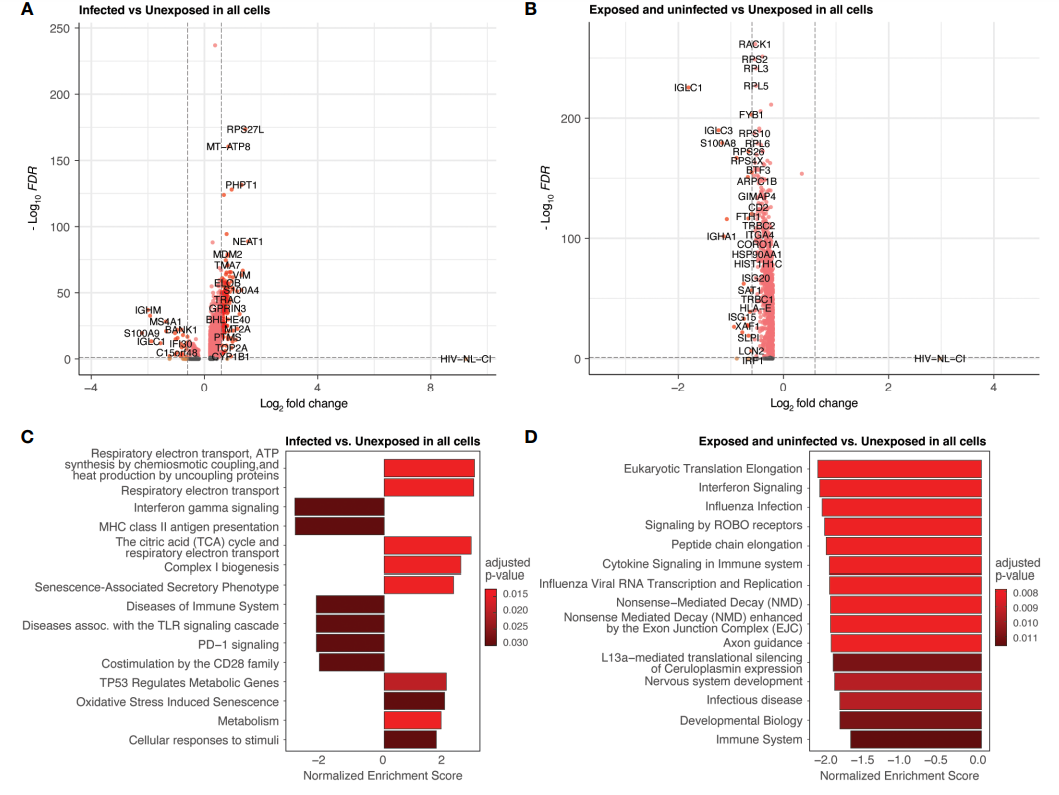
图A和图C:感染的与未暴露的细胞间差异基因及通路富集分析
图B和图D:暴露未感染的与未暴露的细胞间差异基因及通路富集分析
06 Step 6
接着作者选取T细胞分群进行展示,发现感染HIV-1的T细胞表现出氧化磷酸化途径增加。此外,作者也选取了巨噬细胞进行展示,结果发现暴露于HIV但未感染的巨噬细胞表现出炎症信号增加,包括NLRP3炎症小体。
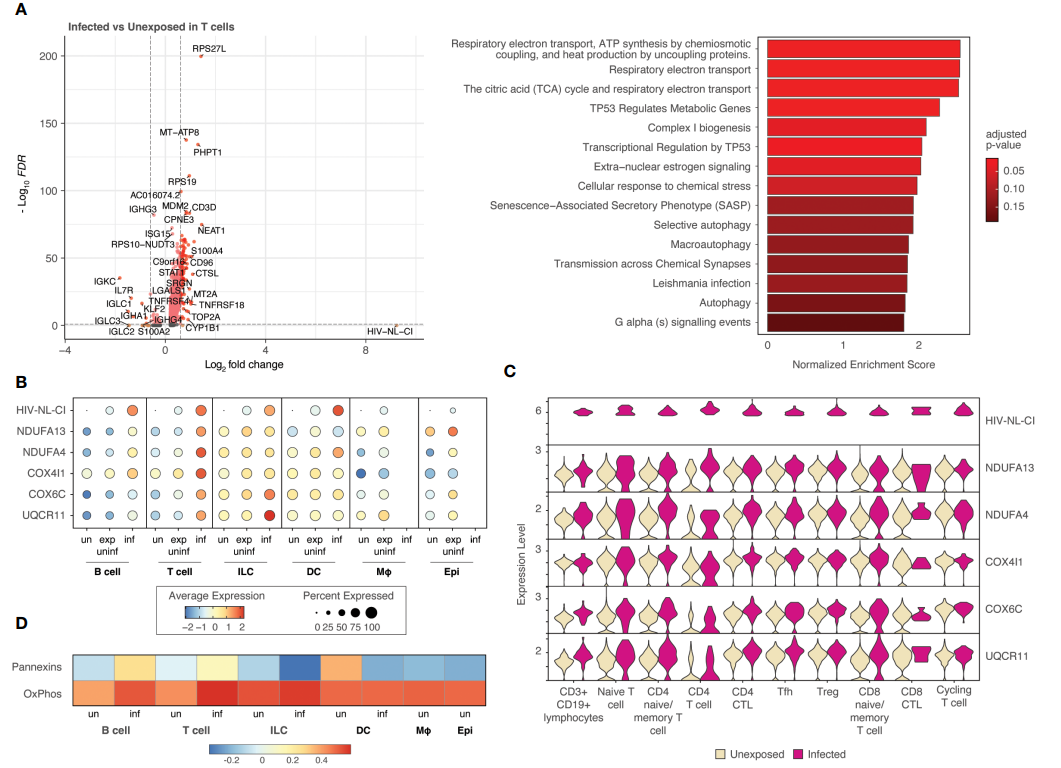
选取T细胞展示
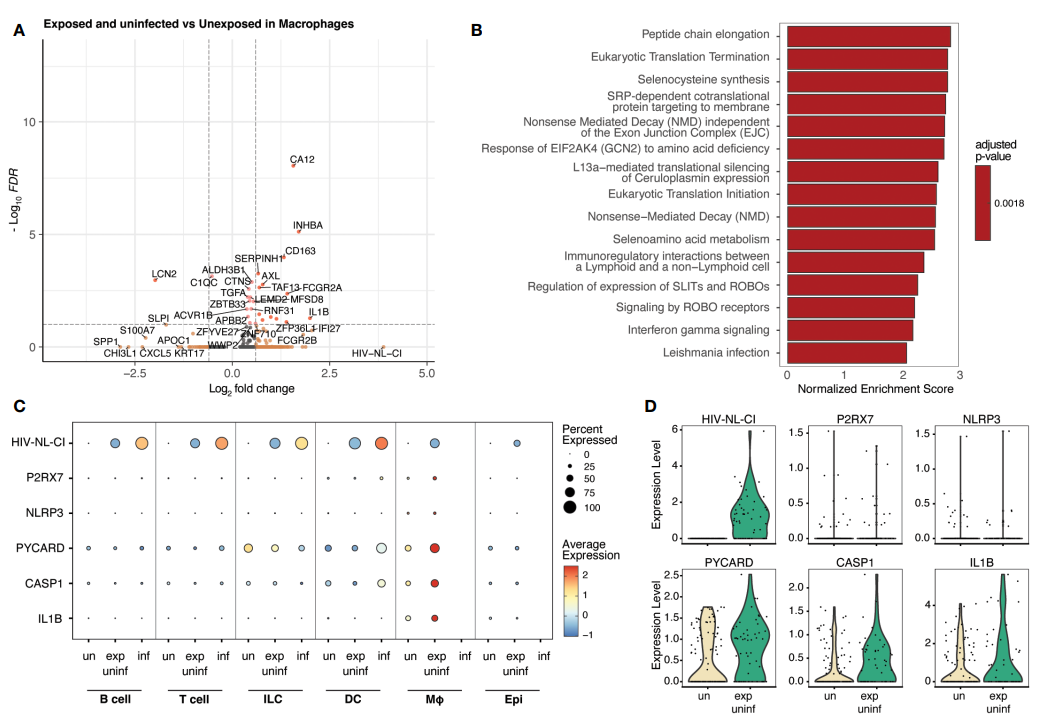
选取巨噬细胞展示
总结
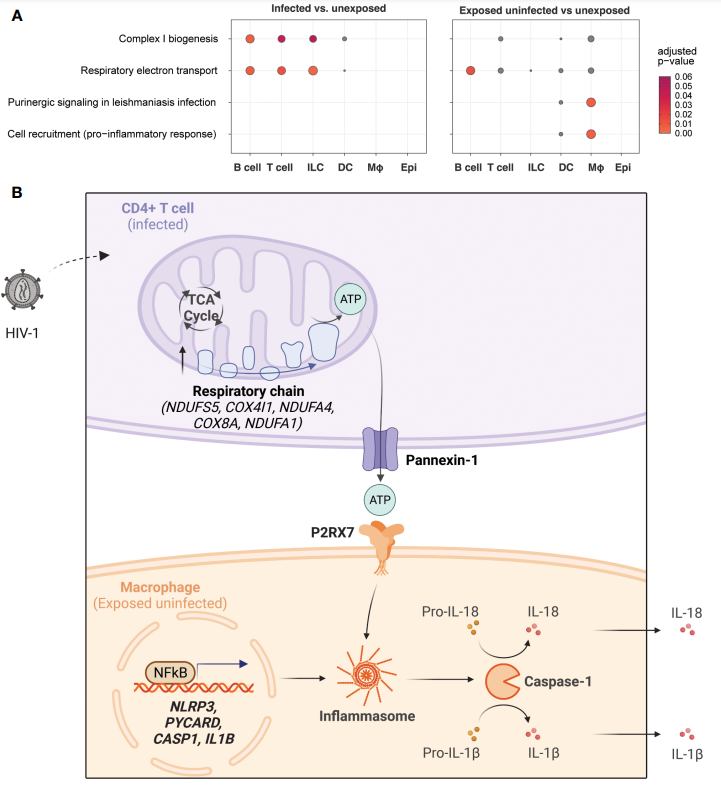
作者认为,感染HIV-1促进了CD4和T细胞的氧化磷酸化,以及巨噬细胞NLRP3的激活。在受感染细胞中,关键氧化磷酸化和层内信号基因富集。
将未暴露的细胞和暴露后未感染的细胞进行对比,发现受感染的淋巴细胞中,氧化磷酸化相关基因富集。而暴露后未感染的细胞中,与层内体信号相关的基因在巨噬细胞中富集。
因此,作者推断出,感染HIV-1会导致CD4和T细胞糖酵解、三羧酸循环和氧化磷酸化增加,从而导致ATP的产生增加,激活了巨噬细胞中的嘌呤能受体P2RX7的信号通路,使得NLRP3肌内体和caspase-1被激活,并释放炎症细胞因子。
也就是说,HIV-1感染增强了CD4和T细胞的氧化磷酸化,同时激活了巨噬细胞的NLRP3炎症小体。
 文章推荐
文章推荐