
好不容易会做了实验,读懂了结果图,做出来的结果却千奇百怪,也不知道是哪里出了问题。今天就给大家整理了CO-IP常见的6大异常条带,逐一分析了造成的原因以及改进办法!
1.在IP实验过程中,检测到的相互作用蛋白的信号较弱?

(1)原因:经分析,存在表达量过低的情况,同时目的蛋白的识别表位可能被互作蛋白所遮盖,以及在实验洗涤过程中目标蛋白可能发生丢失。
(2)改进:
① 为确保实验的准确性,建议在做WB前,首先验证蛋白表达量,并据此提高上样量,或用互作蛋白含量较高的样本进行实验,以确保蛋白的有效检测。
② 选择高亲和力的抗体(IP级别抗体)进行实验,以提高对目标蛋白的识别效率。
③ 在实验开始前,需确定合适的去垢剂和盐离子浓度,以避免在洗涤过程中目标蛋白的丢失,确保实验结果的可靠性。
2.在IP实验中,背景信号偏高或者检测到了非特异性的信号?
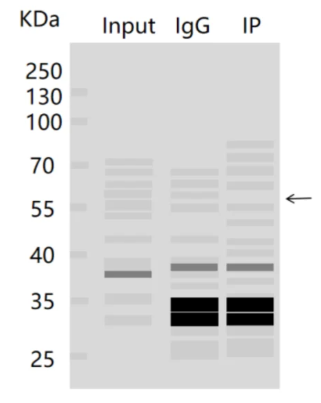
(1)原因:
① Beads的非特异性结合。
② 非特异性蛋白与Beads结合。
③ 抗体浓度过高或特异性不佳。
④ 样本降解。
(2)改进:
① 建议在使用前使用1~5%的BSA进行预封闭处理。
② 免疫沉淀后,应增加漂洗次数和盐离子浓度,以有效减少非特异性结合。
③ 选择合适抗体类型并调整其使用浓度,以减少非特异性结合。
④ 裂解样本时,加入蛋白酶抑制剂或确保样本新鲜制备,以避免样本降解对实验结果的影响。同时,投入适量的样本量,避免样本过多导致的背景信号增强。
3.在Input泳道中未检测到目标蛋白条带,而在IP组中检测到了目标蛋白条带?
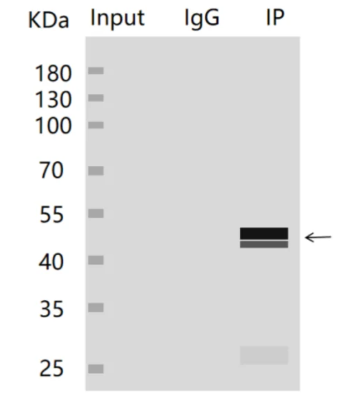
(1)原因:目标蛋白在样本中的丰度较低或存在降解现象,这导致在Input组中未能成功检测到该蛋白,而在IP组经过富集后能够检测到。
(2)改进:为了提升实验的准确性,建议进行常规的WB验证,并在样本处理阶段添加蛋白酶抑制剂以稳定蛋白质。同时,建议适当提高Input组的上样量,以增加检测到目标蛋白的机会。
4.在Input泳道中没有发现预期的蛋白条带,同时在在IP组中也没有观察到任何信号?
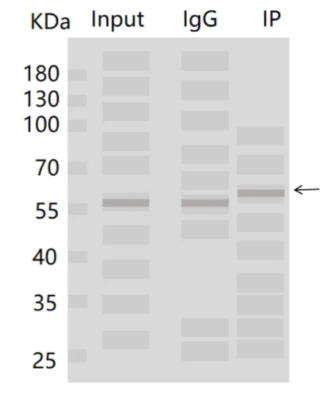
(1)原因:样本降解以及样本蛋白丰度低,导致实验效果不佳。
(2)改进:
① 为防止样本降解,建议在冰上进行样本操作,并在裂解样本时加入蛋白酶抑制剂,尽量多地保留样本中的蛋白质。
② 针对样本蛋白丰度低的问题,若当前样本量无法检测到足够的蛋白,建议提高样本量,以确保实验结果的准确性和可靠性。
5.在Input泳道中观察到了目标蛋白条带,但在IP组中,要么没有检测到信号,要么目标蛋白条带的信号较弱?

(1)原因:
① 样本中抗原含量不足,导致抗体难以与其结合进行有效检测;
② 抗体本身的亲和力较低,也是影响检测效果的关键因素之一;
③ IP抗体未能成功与磁珠结合,进一步影响了检测结果的准确性。
(2)改进:
① 建议采用IP级别的抗体,因为一般而言,IP实验相对于WB实验需要更高亲和力的抗体以提高检测效率。
② 建议选择浓度较高的抗体或增加抗体的使用量。
③ 增加抗体与磁珠的孵育时间,以确保充分结合。
④ 请确保磁珠的正确保存,避免其变质或干燥,以确保实验结果的可靠性。
6.蛋白质分子量与轻重链相近或相同,难以进行区分?
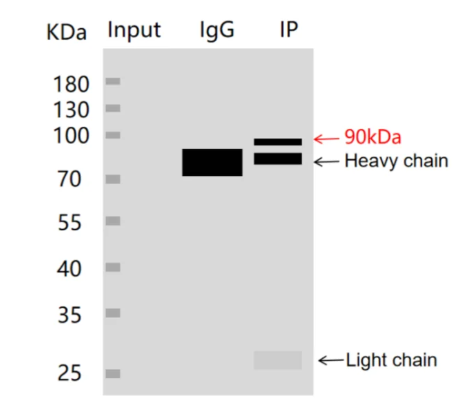
(1)原因:在IP变性洗脱过程中,抗体在高温和还原剂的影响下,会发生变性,进而分解为轻链和重链。
(2)改进:建议采用IP专用的构象二抗,该抗体仅针对目的蛋白具有识别能力,从而避免了轻重链的干扰。此外,若条件允许,可尝试使用不同种属的一抗(需额外购买两种抗体以满足实验需求)。对于WB实验,建议使用直标一抗,但需注意直标一抗可能因无二抗信号放大作用,而导致信号较弱或无法曝光的情况。
 文章推荐
文章推荐