
今天为大家分享的是国自然热点——拟素化(Neddylation)的课题设计思路,相信大家也都很感兴趣。我们将从拟素化的概念、案例分析、研究思路这几个方面展开,为大家详细地介绍。
一、相关概念
1.拟素化修饰(Neddylation)
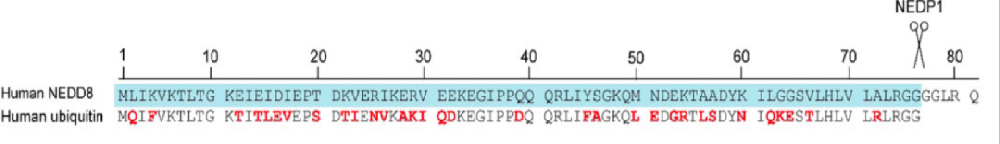
拟素化修饰(Neddylation)是泛素样蛋白NEDD8与底物蛋白结合的特异性修饰过程,是近年来发现的新型蛋白质翻译后修饰。拟素化与泛素化、SUMO化类似,是一系列的酶促反应过程,可以广泛地调节生物学过程,如细胞周期、信号传导和免疫识别等。其中,NEDD8基因的主要产物是NEDD8前体,在作用于其目标之前,需要进行修饰以暴露C端甘氨酸。
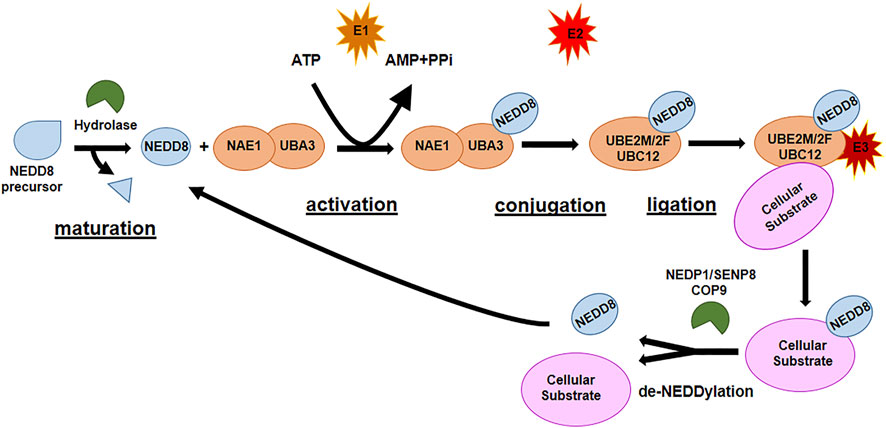
2.调节拟素化的酶
调节拟素化的酶,主要包括NEDD8活化酶(E1)、NEDD8结合酶(E2)和NEDD8连接酶(E3)。从图中我们可以看到,NEDD8活化酶E1(NAE1)以ATP依赖的方式促进NEDD8的激活,然后结合酶E2(UBC12、UBE2F)接受NEDD8并将其转移到E3连接酶上,最后NEDD8保守的C端甘氨酸与其底物的赖氨酸残基之间发生异肽连接。
3.拟素化修饰的常见底物
拟素化修饰的常见底物,主要包括Cullin家族蛋白(Cullin-1、Cullin-2、Cullin-3、Cullin-4A、Cullin-4B、Cullin-5、Cullin-7、Cullin-9)、p53、HuR、BCA3、pVHL、TGF-β2和EGFR等;在这里,还要跟大家特别介绍一点,拟素化修饰与多种疾病相关,对拟素化途径的干扰会导致发育缺陷、肿瘤发生、代谢紊乱、肝功能障碍和神经退行性疾病。
二、案例分析
接下来我们将通过一篇拟素化相关高分文献(“小鼠肝拟素化缺乏后通过激活NF-κB诱导激酶导致致命性肝损伤”)的解读,来学习作者的研究思路~

研究背景
肝脏疾病现已是引起全球范围内健康担忧的疾病之一。急性和亚急性肝衰竭(ALF)通常发生在药物、毒素、病毒感染等诱导的急性肝损伤之后。ALF患者的肝脏实质细胞大量损失导致肝脏快速衰竭,肝移植是唯一干预措施。导致肝毒性的分子机制包括氧化应激、线粒体功能紊乱等。另外,急性肝损伤可导致肝细胞向胆管上皮细胞(BEC)或祖细胞的病理性转化,导致肝脏不能再生或再生不理想。
NF-κB诱导激酶(NF-κB-inducing kinase,NIK),也称为MAP3K14,是一种组成型活性的Ser/Thr激酶,由于快速泛素化和蛋白酶体介导的降解,其在静止细胞中的水平非常低。在患有慢性肝病的患者和小鼠中肝脏NIK会被异常激活,并且已有报道称小鼠肝细胞过表达NIK会触发致死性肝衰竭。但拟素化是否能调节NIK的稳定性和活性从而进一步调节肝功能是完全未知的。
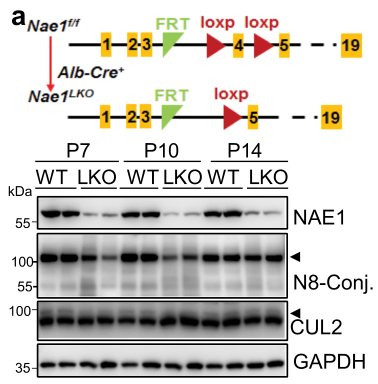
Fig1:胚胎期肝细胞NAE1缺失导致小鼠肝功能障碍和过早死亡
首先,作者针对胚胎期肝细胞NAE1缺失对小鼠肝功能以及死亡率的影响进行了研究。从图a中我们可以发现,LKO小鼠的肝脏中NAE1表达从出生后第7天(P7)到第十四天(P14)开始显著降低,NAE1的缺失导致了在P7和P10时LKO小鼠肝脏中拟素化相关蛋白的缺失。从图b-e可以看到,LKO小鼠在P14之后开始表现出生长迟缓,死亡率增加,只有40%的小鼠可以存活到8周龄;P21时出现了肝肿大,并且LKO小鼠肝脏中出现多个囊肿。
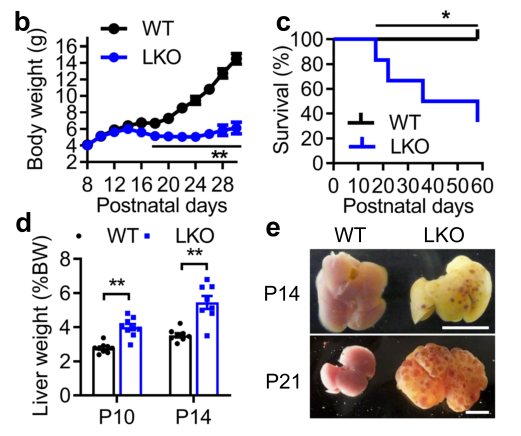
从图f可以看到,LKO小鼠中肝功能相关指标ALT和胆红素水平显著上调;而图g说明了LKO小鼠在P14时肝脏显示与导管增生相关的导管损伤,伴有部分坏死灶和大量炎性细胞浸润;并且通过天狼星红染色可见雄性LKO在P14时肝脏门静脉周围纤维化伴早期桥接现象和细胞周围纤维化。
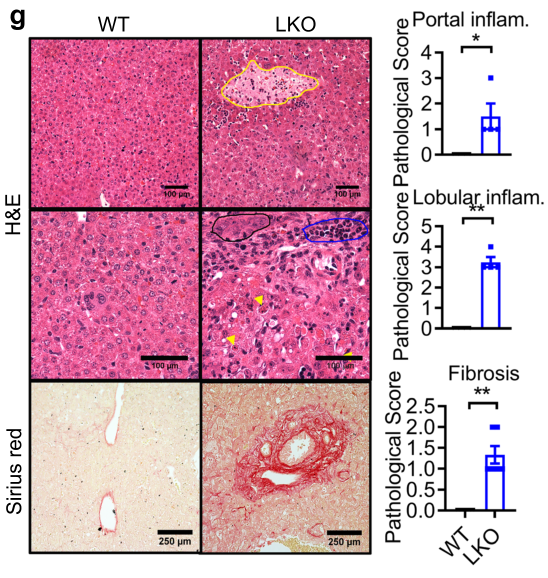
图h-j则表示,LKO小鼠的白细胞标志物基因(Lgals3、Cd68),促炎细胞因子和趋化因子(Ccl2和Cxcl14),纤维化相关基因(Ccn2、Acta2、Col1a1、Col3a1)的表达增加,肝羟脯氨酸含量升高。因此,作者得出结论:胚胎期肝细胞NAE1缺失会导致小鼠肝功能障碍和过早死亡。
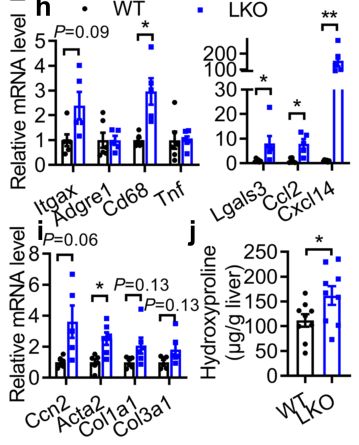
Fig2:成年小鼠肝细胞特异性NAE1的缺失会导致致死性肝损伤
接着,作者进一步研究了成年小鼠肝细胞特异性NAE1的缺失对其肝功能的影响。图a说明,在肝NAE1特异性缺失(AAV-Cre)造模10天后(D10),该小鼠肝脏中NAE1和拟素化缀合物如CUL1的表达降低,表明造模成功。从图b-d中发现,AAV-Cre小鼠的肝脏在D21时显著增大,体重在D24时降低约40%,血浆ALT水平升高,在D24时出现黄疸但无囊肿,并且所有AAV-Cre小鼠在注射后30天内死亡。
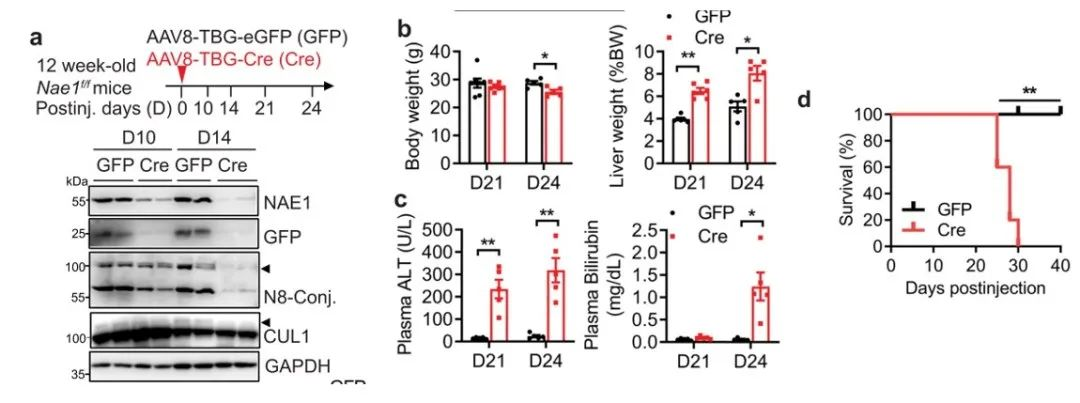
图e显示在D24时,AAV-Cre小鼠肝脏结构完全被破坏,伴有细胞凋亡和小叶中心(肝腺泡3区)坏死以及免疫细胞的显著浸润,天狼星红染色显示,与对照组相比,AAV-Cre小鼠在D24时肝脏纤维化严重。图f主要是在与对照组相比,AAV-Cre小鼠的炎症和纤维化相关基因表达上调,肝组织中羟脯氨酸含量也升高。最终,实验证明成年小鼠肝细胞特异性NAE1的缺失会导致致死性肝损伤。
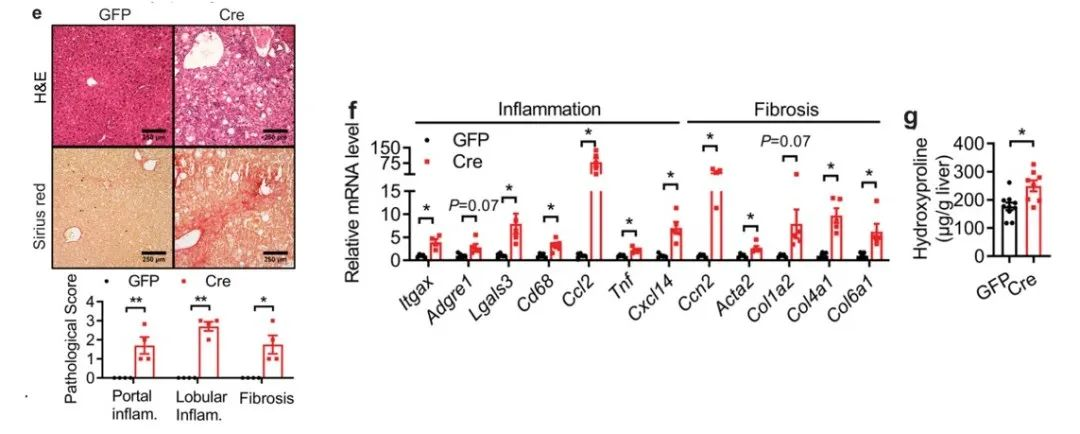
Fig3:肝脏拟素化缺陷会促进肝细胞损伤和过度重编程
在证明肝细胞特异性NAE1的缺失对其肝功能的影响后,作者又针对肝脏拟素化缺陷对肝细胞所产生的影响进行了进一步研究。通过伊文思蓝染色(EBD)和TUNEL染色发现AAV-Cre小鼠细胞坏死水平增加,TUNEL阳性细胞增多。AAV-Cre小鼠在D21和D24时,肝脏中裂解的casp3和casp8及主要的坏死调节因子如MLKL、pRIPK3和总RIPK3显著上调。并且AAV-Cre小鼠在D24时,肝脏几乎没有成熟肝细胞标志物基因的mRNA转录物和蛋白,但BEC/祖细胞标记基因的mRNA转录在肝脏中显著增加。
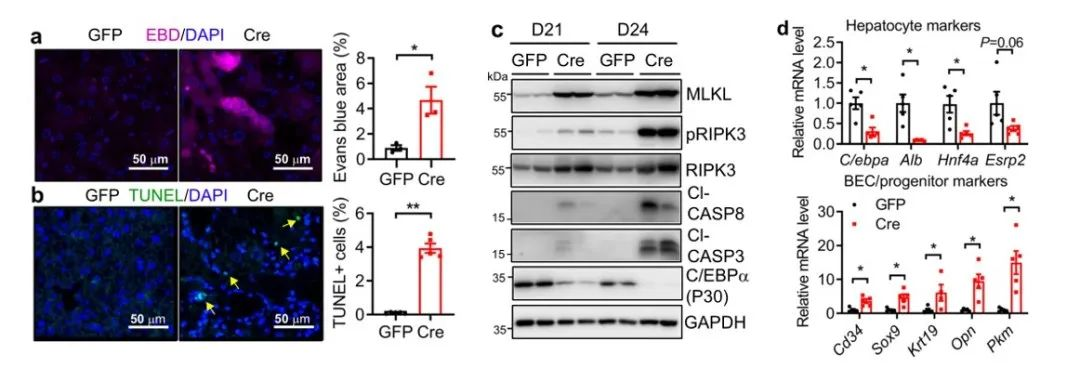
从图e可以看到,免疫荧光染色证实了AAV-Cre小鼠肝细胞核中HNF4α表达减少;相反,KRT19+细胞在门静脉周围区域更丰富。图f中显示,AAV-Cre小鼠肝脏中白蛋白(ALB)和Ki67双阳性细胞增加,表明肝细胞再生增加。因此,我们可以得知,肝脏拟素化缺陷会促进肝细胞损伤和过度重编程。
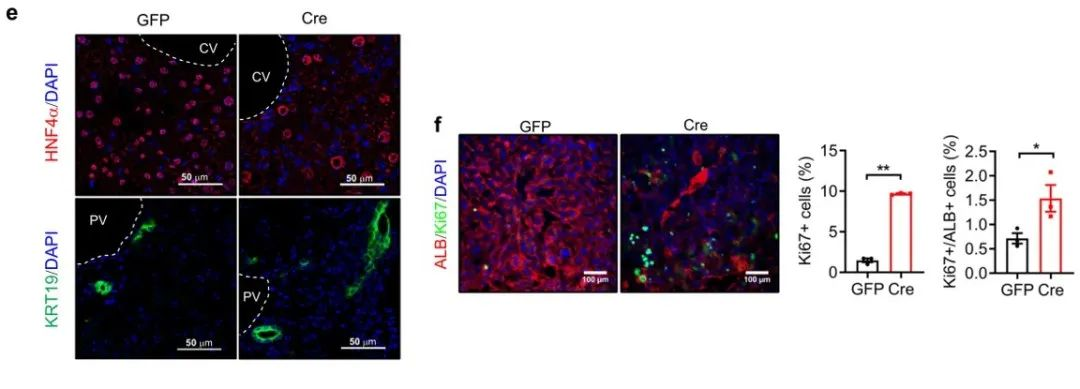
Fig4:肝脏拟素化缺乏激活细胞应激途径,伴随氧化应激升高和线粒体功能障碍
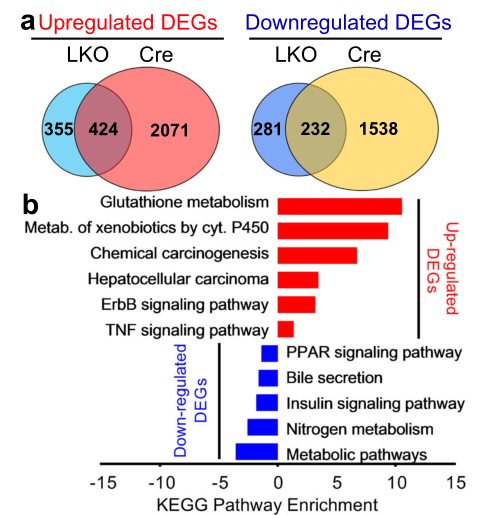
那么,肝脏拟素化缺乏激活细胞应激途径,还是否会伴随氧化应激升高和线粒体功能障碍呢?作者又做了进一步的实验研究。从图a反应出,P10 LKO小鼠肝中总共发现了779个上调基因和513个下调基因,D21 AAV-Cre小鼠肝脏中则有2495个基因上调,1770个基因下调。在LKO和AAV-Cre小鼠的差异表达基因(DEG)中,有424个基因上调,有232个基因下调。从图b反应出,与代谢途径如氮代谢、胰岛素信号、胆汁分泌和PPAR信号相关基因都受到极大抑制。
从图c反应出,D21 AAV-Cre小鼠的DEG与两个ALF相关GSE38941和GSE96851转录组的表达变化呈正相关;图d反应了D21 AAV-Cre肝脏中活性氧(ROS)量增加;图e则反应了,D21 AAV-Cre小鼠GSH水平较低,对比AAV-GFP小鼠,AAV-Cre小鼠GSSG水平以及GSSG/GSH比率较高。这说明,肝脏NAE1的缺失会导致线粒体ROS与GSH失衡,并加重体内免疫细胞浸润继发的氧化应激。
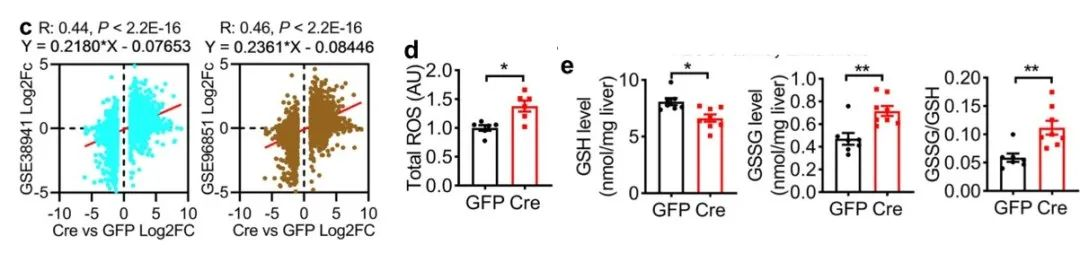
接下来,作者为了进一步确定氧化应激是否是NAE1缺失引起的下游效应,做了以下研究。从图f可以看到,从D12 AAV-Cre肝脏中分离原代肝细胞,证实其NAE1缺失和拟素化减少。从图g可以看到NAE1缺失的原代肝细胞MitoSOX染色程度加重。从图h-j可以看到,NAE1缺失的原代肝细胞GSH水平降低,耦合和非耦合呼吸受到抑制。从图k-i可以看到,NAE1缺失的原代肝细胞ATP含量降低,细胞凋亡增加,细胞存活降低。
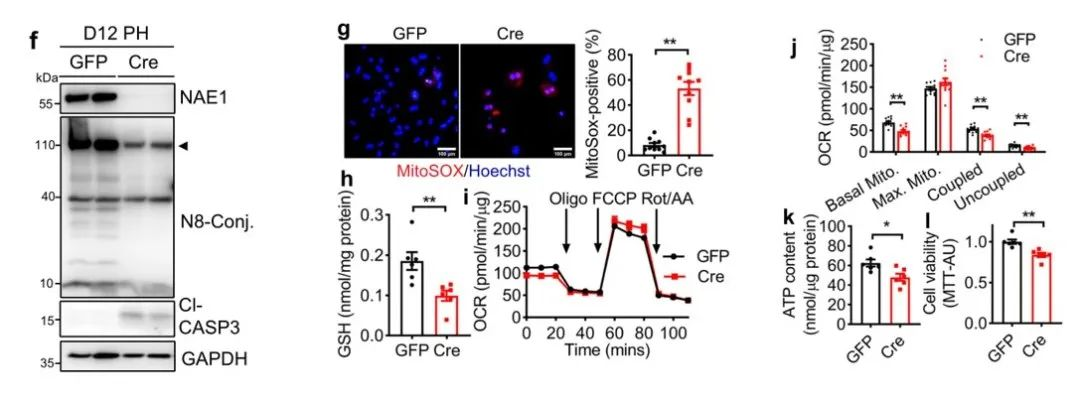
Fig5:肝拟素化缺陷会自主激活成熟胎肝细胞重编
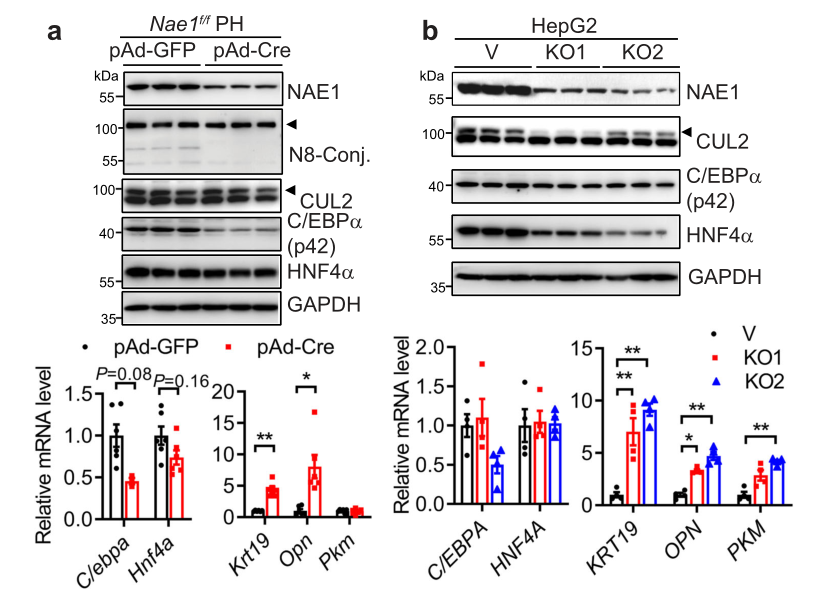
此后,作者又围绕肝拟素化缺陷是否会自主激活成熟胎肝细胞重编展开了进一步研究。从图a可以发现,通过Cre腺病毒(pAd-Cre)感染Nae1f/f原代肝细胞,实现了约50%的NAE1敲低和拟素化抑制,抑制细胞成熟肝脏标志物C/EBPα和HNF4a的mRNA和蛋白水平及BEC/祖细胞基因表达(Krt19和Opn)的激活。从图b可以看到,通过CRISPR/Cas9产生HepG2细胞的两种不同的批量培养物(KO1和KO2),发现其NAE1蛋白表达和NEDD8缀合减少80%,NAE1缺陷的HepG2细胞C/EBPα和HNF4α的mRNA和蛋白表达受到抑制,KRT19、OPN和PKM的mRNA表达明显增加。
我们从图c可以看到,免疫荧光染色证实了KRT19在NAE1缺陷型HepG2细胞中的上调。而图d则显示,在拟素化受到抑制的HepG2细胞中,发现类似的肝细胞重编程。最终,实验证实肝拟素化缺陷会自主激活成熟胎肝细胞重编。
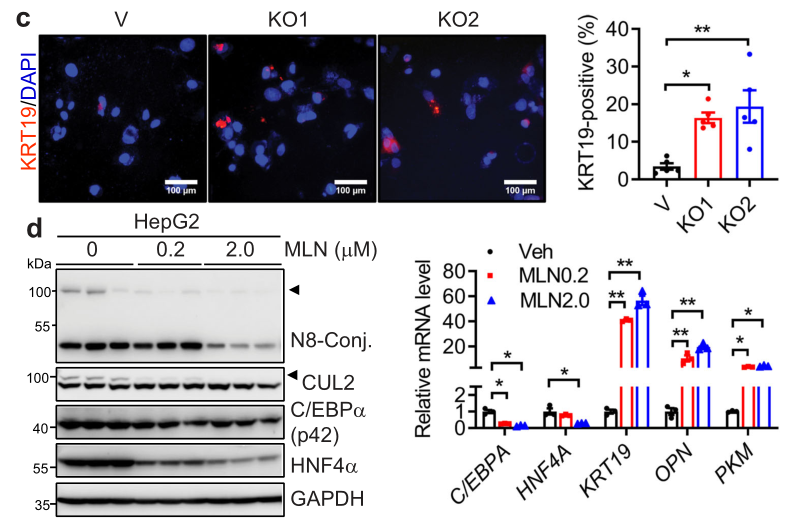
Fig6:肝脏拟素化缺陷积聚NIK导致肝细胞损伤
那么,肝脏拟素化缺陷积聚NIK是否会导致肝细胞损伤呢?在作者进行了相应的实验研究后,得出了实验结果。我们可以从图a-b上看到,NIK在AAV-Cre肝脏、Ad-Cre感染的原代Nae1f/f肝细胞中显著积累。NIK蛋白的积累伴随着磷酸化p100和p52的增加,p52是非经典NF-κB途径中NIK激活的经典生物标志物。上述细胞也观察到了磷酸化p100和p52的增加。
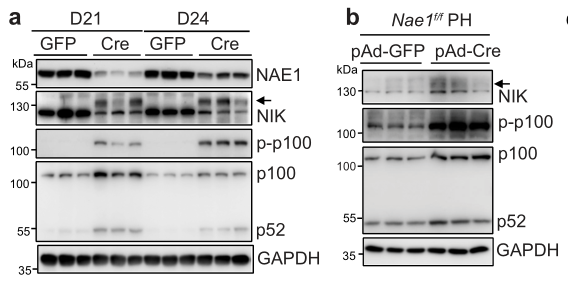
我们从图中可以看到,MLN能够显著延长NIK蛋白的半衰期。NIK特异性抑制剂B022可显著减弱MLN诱导的NIK信号传导,虽然B022不能改善细胞中肝细胞标志基因(HNF4A,C/EBPA)、GCLC和PCK1的表达,但B022处理后可以抑制MLN诱导的由TNFα引发的细胞凋亡。
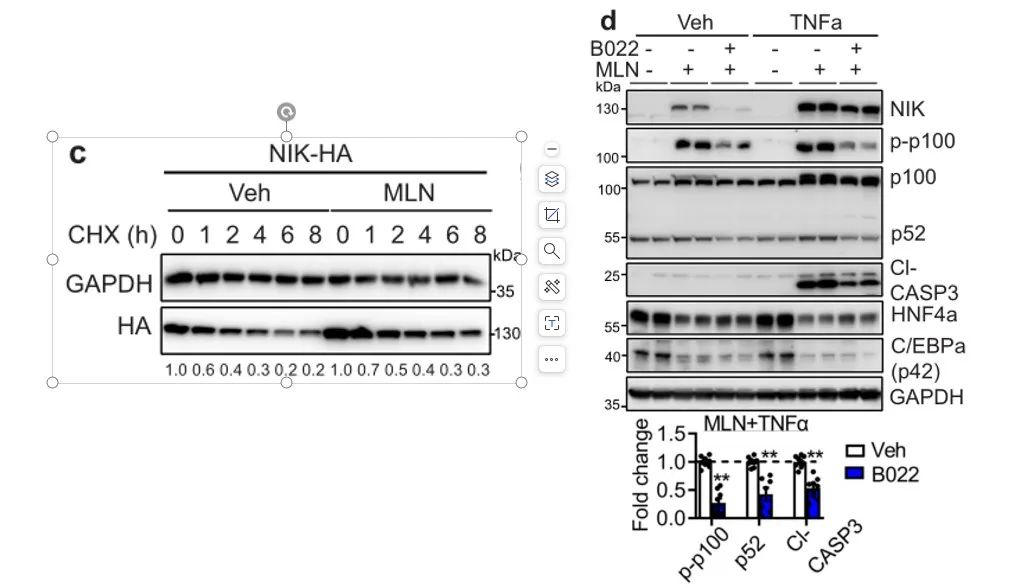
同时,我们发现,B022还可以降低MLN处理的HepG2细胞或原代肝细胞中KRT19的表达。AAV-Cre小鼠在给药B022的14天后肝脏中磷酸化p100和p52积累量减少了50%,显著减轻了肝脏中RIPK3的上调,但其磷酸化和MLKL表达不受影响。B022还显著减弱了炎性因子如Lgals3的表达,显示出了抑制AAV-Cre小鼠肝脏中祖基因(Krt19,Pkm)激活的趋势。这也就是说,肝脏拟素化缺陷积聚NIK会导致肝细胞损伤。
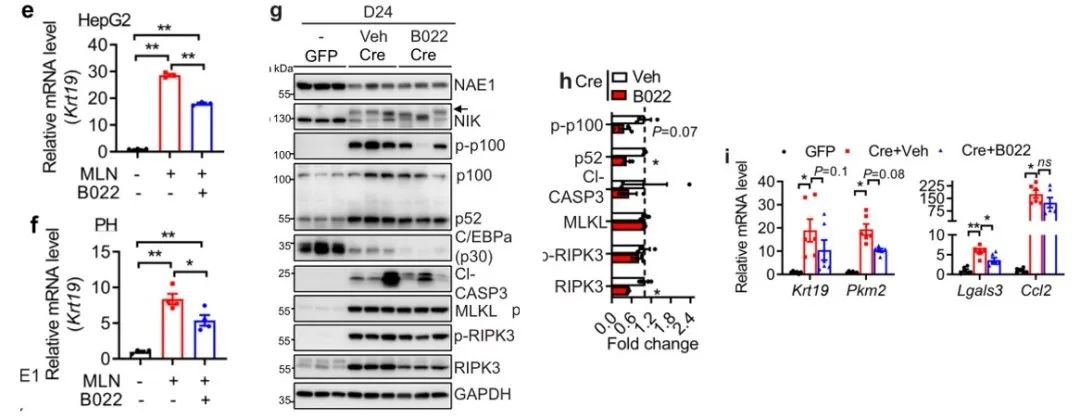
Fig7:NIK是拟素化的直接底物
接着,鉴于NIK在肝脏中发挥重要作用,作者探究了拟素化如何调节NIK。从图a我们可以看到,通过免疫印迹可检测到WT-NEDD8细胞中拖尾的拟素化NIK表达,但在NEDD8缺陷突变体(ΔGG)细胞中则未能检测到。并且通过MLN抑制拟素化或者沉默拟素化E2酶UBC12均显著降低了拟素化NIK丰度。从图c可以看到,过表达拟素化蛋白酶8(SENP8)也显著地降低了拟素化NIK水平。然后在图d中看到,SENP8的缺失或下调导致了总拟素化蛋白的积累和拟素化NIK的增加。
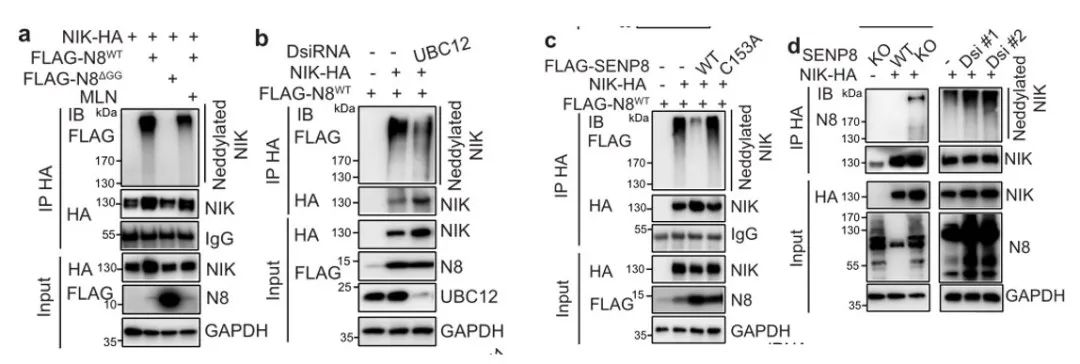
在这里我们可以看到,通过免疫沉淀进一步发现了HepG2细胞和原代肝细胞中内源性UBC12和内源性NIK之间的相互作用,说明了拟肝素酶参与了NIK的拟素化。还可以看到,人类NIK中包含59个赖氨酸残基,其中49个在小鼠和人类NIK之间是保守的。而所有保守赖氨酸残基(K49R)或C-末端的(aa385-947)20个保守赖氨酸残基(K20R)突变消除了NIK拟素化,N-末端(aa1-384)29个保守赖氨酸残基(K29R)的突变并不改变NIK拟素化状态。
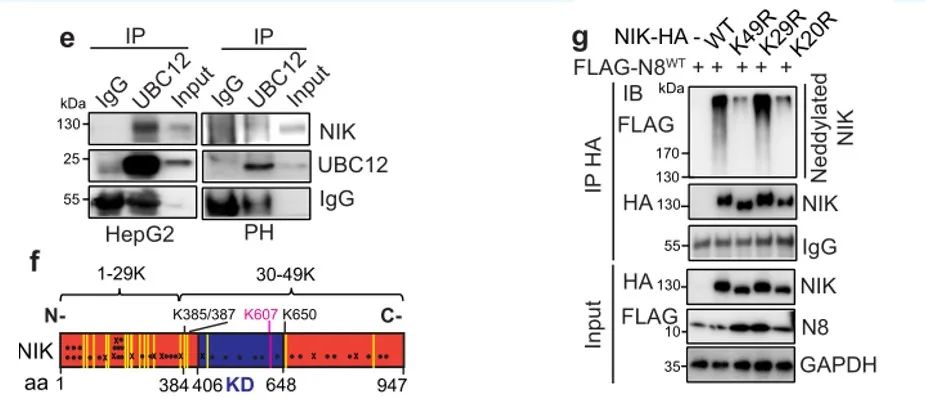
从图h可以看到,NIK上四个赖氨酸残基突变(K385R/K387R/K607R/K650R;K4R)显著降低其拟素化水平,这里只展示了一个位点,其余位点结果在附加材料里。通过下拉实验发现,UBC12或NEDD8的消耗显著降低了NIK泛素化。然而,NIK K4R似乎比其WT对应物更稳定,当转染相同量的质粒时,NIK K4R的蛋白水平高于其WT对应物的蛋白水平。当经过BZM或MLN处理后,蛋白水平差异消失,说明上文提到的NIK四个赖氨酸残基突变位点参与介导拟素化和蛋白酶体调节的NIK蛋白稳定性。从图k可以看到,NIK K4R突变体具有比WT更慢的蛋白周转速率,说明与NIK蛋白稳定性相关,这也说明NIK的拟素化促进了其泛素化和降解。显而易见,NIK是拟素化的直接底物。
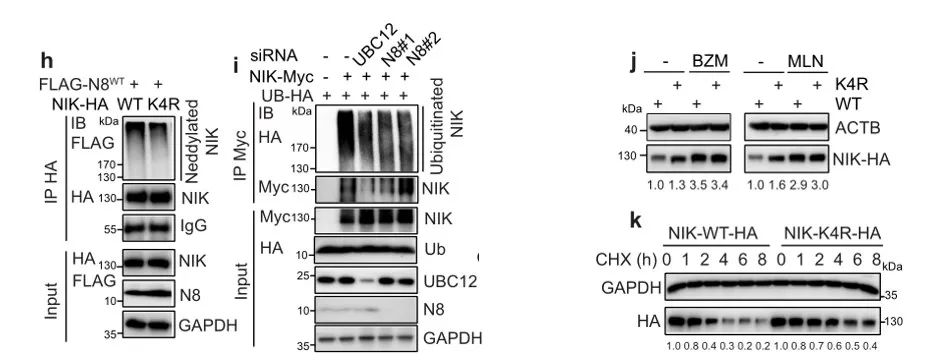
Fig8:NAC治疗可以缓解部分拟素化缺陷诱导的ALF
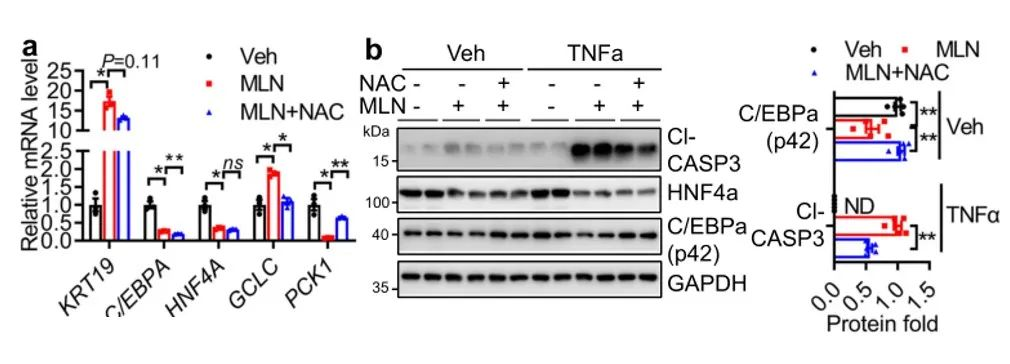
上面我们提到,拟素化缺乏会导致氧化应激水平升高。NAC是一种抗氧化剂,可有效抑制肝脏疾病中的氧化应激和炎症水平。因此,作者进一步研究了NAC治疗是否可以缓解部分拟素化缺陷诱导的ALF。从图中可以看到,NAC可以略微抑制MLN诱导的HepG2细胞KRT19上调,而不恢复肝细胞标志物基因(HNF4A,C/EBPA)的表达。然而,它还成功地逆转了GCLC的上调,并且恢复了PCK1基因表达和C/EBPα蛋白表达。在NAC与MLN一起处理细胞后,肝细胞对TNFα诱导凋亡的敏感性显著降低。
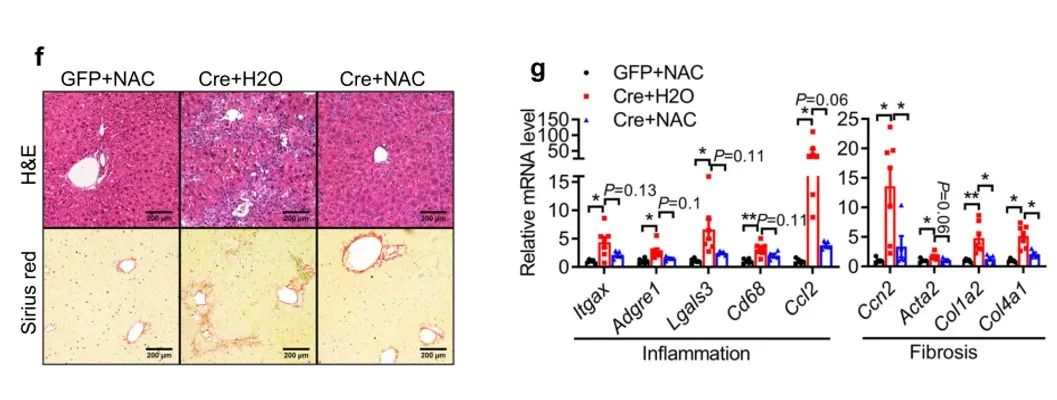
我们从这几张图可以看到,对比AAV-Cre小鼠的100%死亡率,NAC喂养的AAV-Cre小鼠死亡率为70%。虽然NAC喂养的AAV-Cre小鼠血浆ALT只些许降低,但其血浆胆红素水平完全恢复到了AAV-GFP小鼠的正常水平。NAC治疗不影响AAV-Cre组中NAE1的缺失,但在治疗之后恢复了AAV-Cre小鼠中肝细胞标志物的mRNA和蛋白质表达,并抑制了BEC/祖细胞标志物基因的上调。并且在NAC治疗后,AAV-Cre小鼠肝脏中凋亡和坏死蛋白的上调减弱。
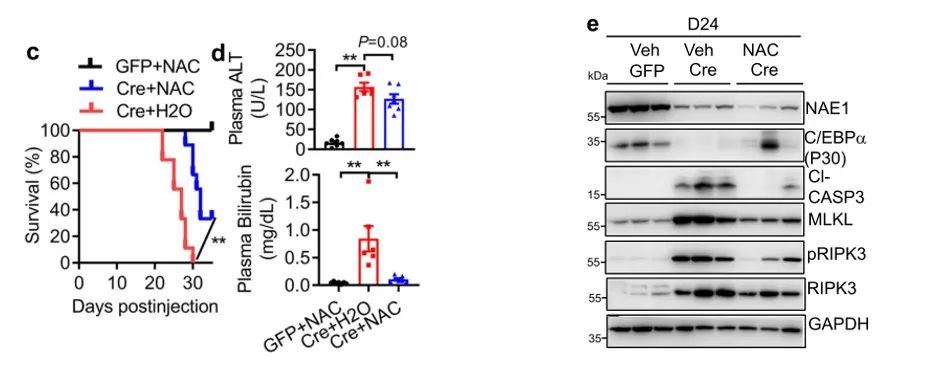
从病理切片结果可见治疗后小鼠肝脏结构有所改善,炎性细胞浸润减少,肝纤维化程度降低;并且其炎性相关基因和细胞因子的mRNA水平也有所降低。这说明,NAC治疗可以缓解部分拟素化缺陷诱导的ALF。
三、研究思路
Fig1-2:确定NAE1在体内的功能
Fig3-5:探究拟素化缺乏对肝损伤的影响
Fig6:探究NIK是否参与拟素化缺陷诱导的ALF疾病
Fig7:确定NIK是拟素化的直接底物
Fig8:研究NAC对拟素化缺陷诱导的ALF的治疗作用
经过上面的详细分析,我们发现,本研究揭示了拟素化在调节新生小鼠和成年小鼠的肝细胞功能的重要性,当拟素化受到影响时,肝细胞会发生损伤及重编程,并激活包括氧化应激,线粒体功能障碍在内的细胞应激途径。另外,作者确定了拟素化受损后的下游靶点,发现其会导致肝细胞中NIK的累积,进一步激活非经典NF-κB通路而后引起细胞损伤。
那么,研究思路具体应该如何设计?一般而言,像蛋白拟素化研究,主要包括以下几个步骤:
第一步,先确定目标蛋白是否存在拟素化;
第二步,鉴定拟素化位点;
第三步,解析拟素化对目标蛋白的影响;
最后,探究目标蛋白拟素化的生物学功能。
另外,小编还为大家整理了国自然中标项目及相关文献。

国自然中标项目

相关文献
 文章推荐
文章推荐