
组织切片技术是生物医学领域中常用的一种技术,它通过对生物组织的显微切片制备、观察和分析,来研究生物体的微观结构和功能。我们在具体的实验过程中可以根据研究目的选择不同的组织切片方法,目前已知常用的有以下几种:
冰冻切片
石蜡切片
超薄切片
碳蜡切片
塑料切片
振动切片
1. 石蜡切片

用途:常用于HE染色、免疫组化、特殊染色等。
优缺点:优点是组织结构保存完好,能切连续薄片,组织结构清晰,抗原定位准确,可以长期保存切片,方便随时观察对比;缺点是切片制作过程中要经过酒精、透明剂等各种有机溶剂的处理,导致组织内抗原活性失去太多。
注意事项:
①及时固定:标本离体后,需在30min内进行固定
②充足的固定液:4~10倍固定液
③切开大组织:多切面切开,以便固定液更好渗透
④合适的容器:选择宽口、宽底的容器,防止样本变形
⑤固定时间范围:12~72h
⑥储存条件:常温、阴凉、密封储存
2. 碳蜡切片
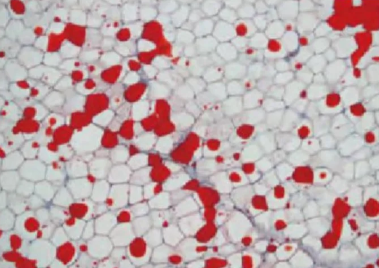
用途:常用于HE染色、免疫组化、特殊染色等,与石蜡切片相似。
优缺点:优点是操作步骤简易,组织不会被机溶剂损害,抗原性保存比石蜡切片好,组织结构清晰;缺点是夏季室温较高时切片较困难,连续切片不如石蜡切片顺利,并且因碳蜡的强吸湿性而难以长期保存。
注意事项:
①组织块尺寸:≤1.5cm×1cm×0.1cm,避免过大
②避免沾水:在操作过程中,碳蜡组织块应尽量避免与水或冰接触
③等量混合碳蜡液:一般在52℃时,使用1500:4000等量混合液;当气温高湿度大时,则可以调整为4000:1500的混合比例
④储存条件:密封、干燥、冷藏
3. 冰冻切片
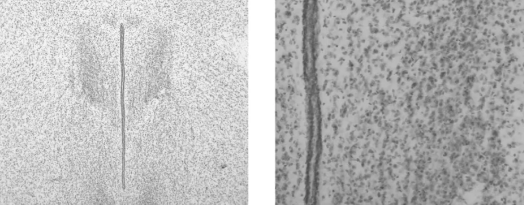
用途:常用于现代免疫荧光诊断和免疫组织化学中。
优缺点:优点是能够较完好地保存细胞膜表面和细胞内多种酶活性以及抗原的免疫活性。缺点是组织在切片前需要冰冻,而冰冻过程容易使组织中的水分形成冰品,从而影响抗原定位。
注意事项:
①新鲜组织:使用新鲜的未经固定处理的组织标本
②避免沾水:及时用吸水纸擦拭,避免因形成冰晶而影响切片质量
③超低温保存:无法及时制备时,需-80℃冻存
④冰冻切片保存:-20℃低温保存,防止切片的退化和失去活性
⑤制片时间:≤30min
4.超薄切片
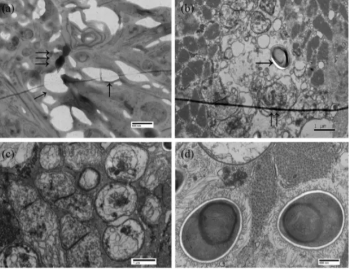
用途:专用于透射电镜观察,揭示生物结构与功能的关系。
优缺点:优点是利用透射电镜电子束穿透超薄切片,可便于研究观察组织、细胞、微生物等内部结构,及其内部的生物大分子复合体或者细胞器等超微结构;缺点是操作过程较为复杂,且部分细微样品可能会被电子束损坏。
注意事项:
①取材部位:选择具有代表性的区域进行电镜切片制备
②尽快固定:从活体取下后,1~3min内浸入预冷(4℃)固定液中
③避免机械损伤:使用锋利的刀片轻轻切割,避免造成机械损伤
④低温保存和操作:大约4℃
4. 塑料切片
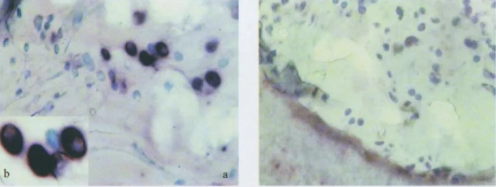
用途:常用于组织化学和免疫组化染色、骨和骨髓标本的切片、塑料薄切片高分辨显微镜观察。
优缺点:优点是塑料切片可以不经有机溶剂脱水,并在常温或低温下完成整个操作程序,因此能较好地保留脂肪及酶的活性;缺点是塑料切片组织中的塑料不能回收,切片速度较石蜡切片速度更慢,塑料包埋技术所用的部分试剂有毒(如N、N二甲基苯胺)或属于危险物品(如过氧化苯甲酰完全干燥会引起爆炸)。
注意事项:
①组织块尺寸:≤2mm×3mm,不宜过大
②固定液:除重铭酸钾外,其它各种固定液均可使用
③固定时间:一般为12~24h,16~18h更宜
④浸透程序:水溶性HEMA的浸透可在室温或低温下进行,若使用环氧树脂和疏水性丙烯酸树脂浸透则应加温;浸透时间一般为12~18h
5. 振动切片
用途:主要用于显示神经系统抗原分布的研究。
优缺点:优点是简单快速,可以做活体切片,有利于组织化学或免疫组织化学染色;缺点是切片较厚(20~400um左右),分辨率较差,切片标本不易长期保存等。
注意事项:
①新鲜组织:不固定、不冷冻
②切片厚度:20~400um
③包埋温度:琼脂糖水溶液冷却至50~60℃左右时再进行操作,若为低熔点琼脂糖,则需冷却到更低温度,以免温度过高损伤样品
 文章推荐
文章推荐