
今天我们要学习的内容是:NK细胞的基础概念及其研究思路。众所周知,NK细胞不仅与抗肿瘤、抗病毒感染和免疫调节有关,而且在某些情况下参与超敏反应和自身免疫性疾病的发生,能够识别靶细胞、杀伤介质!它对于我们人体来说,是一个不可或缺的功臣!
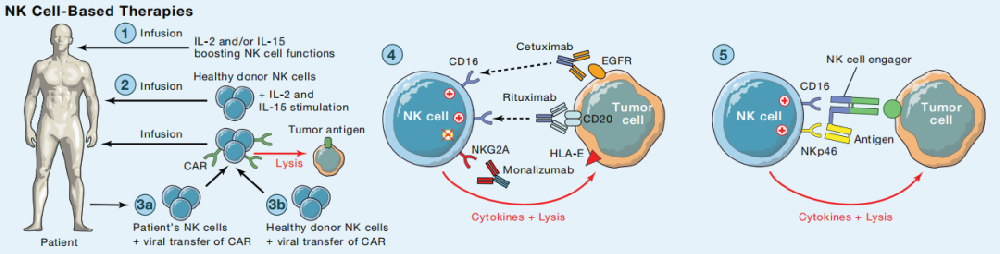
一、相关概念
NK细胞来源于骨髓淋巴样干细胞,是广泛分布的细胞毒性淋巴细胞,在先天免疫系统中起着核心作用。且它随着血液系统在全身不断循环,发挥免疫监视的功能,无需抗原预先致敏就能杀伤肿瘤细胞、病毒感染细胞和其他生理应激细胞(如衰老细胞)等。它具有无主要组织相容性复合体(MHC)限制性和应答速度快两个主要特点。
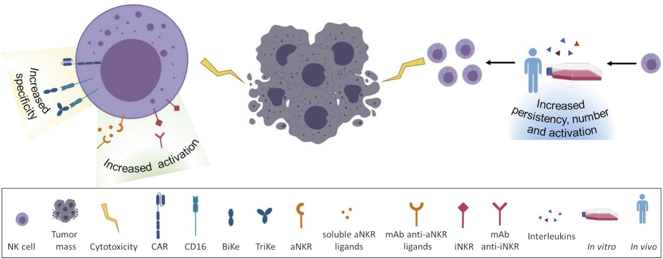
NK细胞表达两类受体:一类是抑制NK细胞杀伤作用的受体,称为NK细胞表面抑制性受体,包括Tim-3、NKG2A、LAG-3、TIGIT等;另外一类是激发NK细胞杀伤作用的受体,称为NK细胞激活性受体,也就是活化性受体,包括NKp46、NKG2D、NKP30等。
1.那么NK细胞是如何对靶细胞进行识别并杀伤的呢?
首先进行“身份核验”:我们都知道,正常细胞表面都会展示MHC-I分子,以防止免疫系统攻击。然而,癌细胞有时会偷偷摸摸地减少或丢失MHC-I的表达,试图躲过免疫监测。不过,机智的NK细胞可不会被蒙蔽,它们正是通过识别缺乏MHC-I的细胞,锁定并攻击癌细胞。
第二步开启“一键激活”模式:当NK细胞的表面受体与目标细胞接触时,活化性受体可能会被激活,而抑制性受体则可能被抑制。例如:当病毒感染细胞和肿瘤细胞表面MHCⅠ类分子表达减少、缺失,或由于MHCⅠ类分子结构发生异常时,NK细胞的抑制性受体不能识别相应配体,激活性受体占主导作用使NK细胞活化并发挥杀伤活性,导致病毒感染细胞和肿瘤细胞坏死或凋亡。
2.被激活后的NK细胞则主要通过以下几条途径杀伤靶细胞:
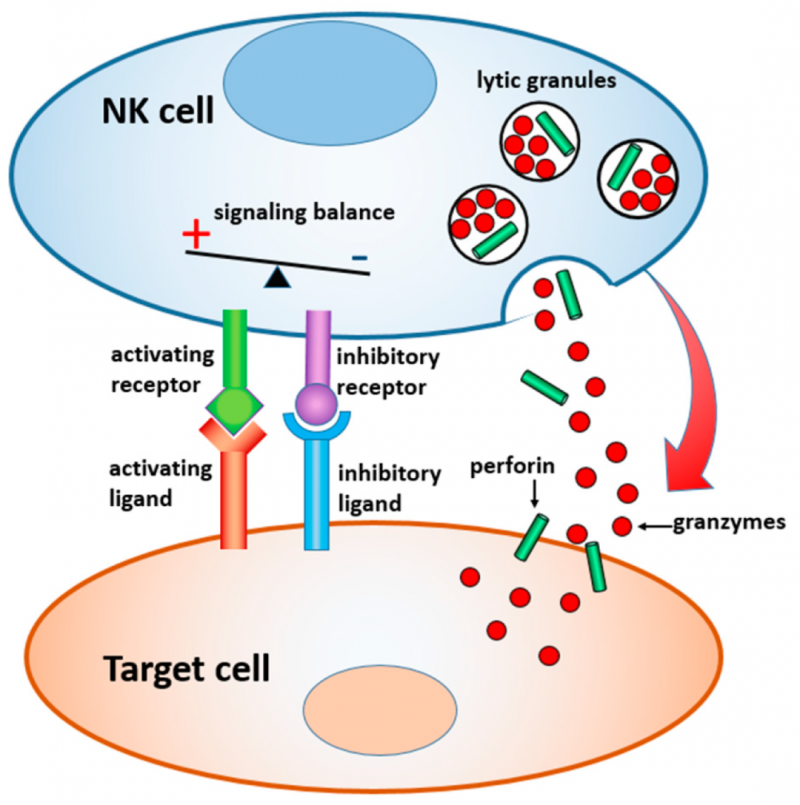
① 释放活性介质。比如:穿孔素和颗粒酶,当穿孔素在靶细胞上形成“孔洞”后,可致靶细胞坏死;同时,颗粒酶可进入靶细胞,通过激活内源性核酸内切酶系统,使靶细胞DNA断裂而导致细胞凋亡。
② 死亡受体/配体相互作用。NK细胞通常表达3种死亡配体:Fas配体(FasL)、TNF配体和TNF相关凋亡诱导配体(TRAIL),这些配体通过与肿瘤细胞表面相应死亡受体结合引起细胞凋亡。
③ 抗体依赖性细胞介导的细胞毒性作用(ADCC)。NK细胞表达的CD16与靶细胞的IgG Fc段结合,通过信号传导使其活化,进而对靶细胞选择性攻击,发挥抗体依赖的细胞介导的细胞毒性作用(ADCC)。
④ 分泌一系列的细胞因子和趋化因子。NK细胞能分泌干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)、白细胞介素-2(IL-2)等多种细胞因子。其中,IFN-γ能抑制肿瘤细胞增殖,阻断肿瘤血管形成以及上调细胞MHC分子表达来刺激抗原提呈;TNF-α活化靶细胞核酸内切酶,降解DNA,引起程序性细胞死亡;IL-2刺激NK细胞增殖,增强其杀伤活性。
二、案例分析
在了解NK细胞的相关知识点后,我们来阅读一篇关于NK细胞的高分文献吧。
这是一篇影响因子为13.6的文章,名为“放疗通过CXCL8协调自然杀伤细胞依赖的抗肿瘤免疫反应”。

研究背景
当前,放射治疗是一种主要的癌症治疗方法,可以单独使用或与化疗药物联合使用。肿瘤细胞在高剂量辐射暴露后进入细胞衰老状态,伴随着可溶性介质的释放。在这些介质中,细胞因子白细胞介素-6和白细胞介素-8(CXCL8)可以诱导肿瘤的侵袭和转移,与各种肿瘤类型的癌症患者不良的总生存率有关。而NK细胞正通过过继转移等方式被用于癌症治疗,此外,更常见的方式是将NK细胞与治疗性抗体(如西妥昔单抗)结合,通过之前提到的Fc受体CD16介导ADCC的途径来实现对肿瘤细胞的杀伤。但目前NK细胞难以浸润实体瘤的事实,成为了阻碍了其发挥抗肿瘤活性的原因。因此,文章作者假设,当治疗性抗体与高剂量辐射结合时,可能有助于NK细胞对肿瘤细胞的结合,并对此展开研究。
接下来就和我一起探寻作者的整个研究过程吧~
现有研究已经证明,在胰腺癌、卵巢癌等实体瘤中,衰老相关的CXCL8能够通过CXCL8/IL-8依赖机制,诱导NK细胞等先天免疫监视细胞在放疗下进行增殖和定向浸润。
Fig 1放化疗联合治疗(RCTX)调节胰腺癌患者CXCL8浓度和NK细胞数量
为了探究放化疗联合治疗对胰腺癌患者CXCL8浓度和NK细胞数量的影响,作者在一项随机对照临床试验中,分别对接受RCTX后联合吉西他滨和西妥昔单抗维持治疗(B组)以及吉西他滨单独治疗(A组)的胰腺癌患者进行了白细胞和细胞因子水平测定。血清细胞因子分析结果显示:只有CXCL8浓度在RCTX期间显著升高,并且全血基因表达数据的白细胞亚群去卷积显示:RCTX期间外周血中静息NK细胞数量有一过性下降;之后作者这些患者的生存时间进行了生存分析,结果显示:治疗前CXCL8血清水平与中位总生存期(mOS)之间无显著负相关性;而在西妥昔单抗维持治疗中,血清CXCL8水平高于中位值(29.8pg/ml)的患者mOS更高;我们还可以看出治疗前高于中位的NK细胞数量与mOS延长有很强的预后相关性;在B组治疗中,外周血NK细胞下降中位数以上的患者mOS延长。
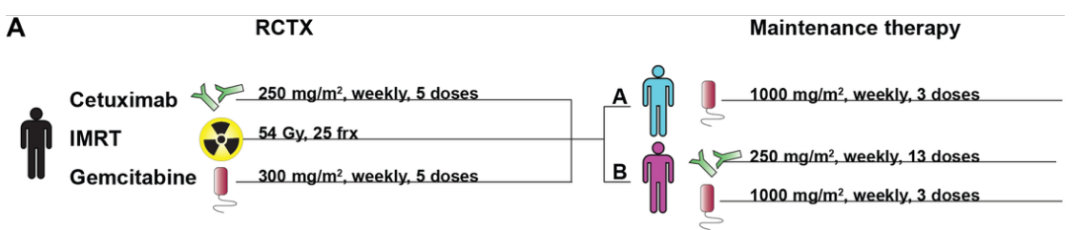
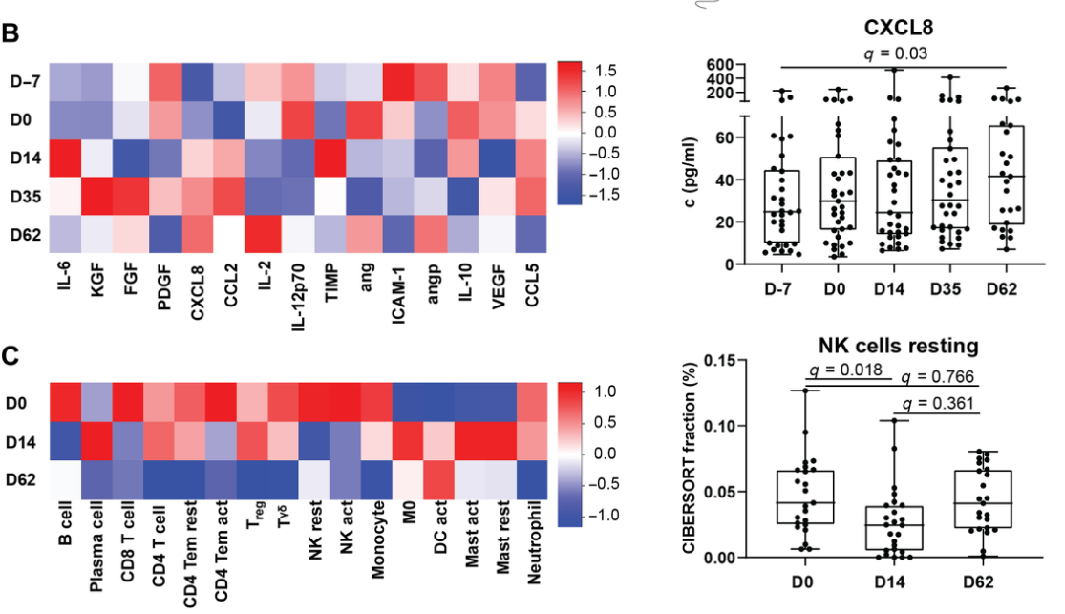
由此我们可以得出结论:在接受西妥昔单抗治疗的放疗胰腺癌患者中,CXCL8水平的升高和NK细胞的外流均与生存相关。且放化疗联合治疗(RCTX)可调节胰腺癌患者CXCL8浓度和NK细胞数量。
Fig 2胰腺癌浸润的NK细胞表现出CD56dim样细胞毒性转录组状态
接着作者评估了胰腺癌患者的NK细胞丰度和表型。在对照射(RT)和未照射(non-RT)患者肿瘤组织进行NKp46免疫组化染色后,作者发现与对照患者相比,经RCTX治疗的病人肿瘤中优先聚集NK细胞,随后作者在使用公共单细胞RNA测序数据评估pdac浸润NK细胞的转录组状态,并分析胰腺癌浸润NK细胞的表型和趋化因子受体表达模式后,发现在未受照射的胰腺癌和正常胰腺组织中,NK细胞中Fc受体(FCGR3A)高表达,标志NK细胞的CD56dim样表型,可能是NK细胞对西妥昔单抗等治疗性抗体产生反应的原因;此外,差异基因表达谱和随后的基因集富集分析结果显示,在所有白细胞中,NK细胞表达最高水平的细胞毒性介质;GZMB、PRF1、FGFBP2和FGFBP2是CD56dim样肿瘤浸润NK细胞中上调最多的基因。
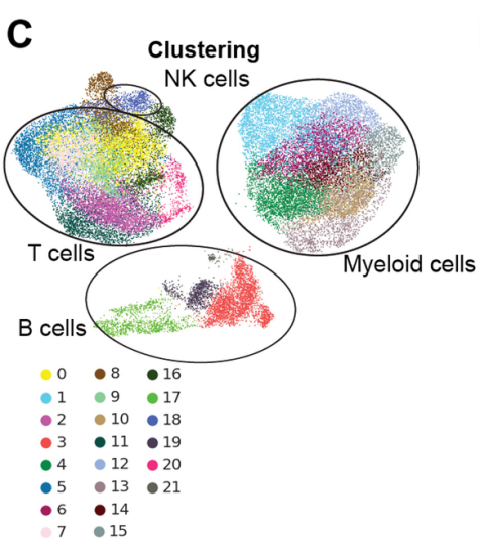
由此我们可以得出:胰腺癌浸润的NK细胞表现出CD56dim样细胞毒性转录组状态。
Fig 3辐射触发CXCL8释放和NK细胞向受辐射肿瘤迁移
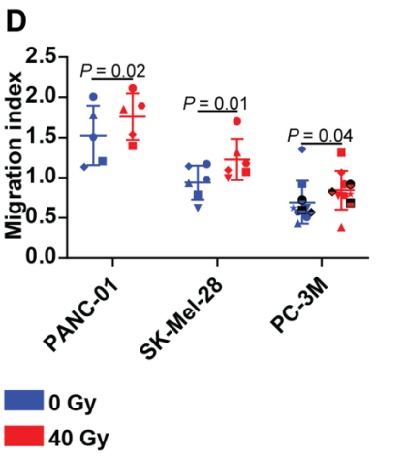
接下来,作者围绕辐射对CXCL8释放和NK细胞的影响展开了研究。在对每个细胞系分别进行2-4次独立实验辐照后,作者发现辐射仅显著诱导CXCL8表达,且在3个胰腺癌细胞系和前列腺癌细胞株(PC-3M)中,辐射诱导的CXCL8释放在二维单层和三维球体系统中均呈时间和辐射剂量依赖性,同时辐射也上调了CXCL8的转录表达。接着作者进行了体内实验,即对小鼠静脉注射转染荧光素酶的SK-Mel-28黑素瘤细胞,并进行20gy肺场照射/假照射,作者发现受照射的异种移植小鼠中显示更多的CXCL8阳性转移和转录表达;肿瘤照射后,静脉注射激活的NK细胞过夜,发现外周血中的NK细胞数量下降,并且在受照射的肿瘤中累积,这表明辐射诱导的NK细胞从外周
血进入肿瘤组织。
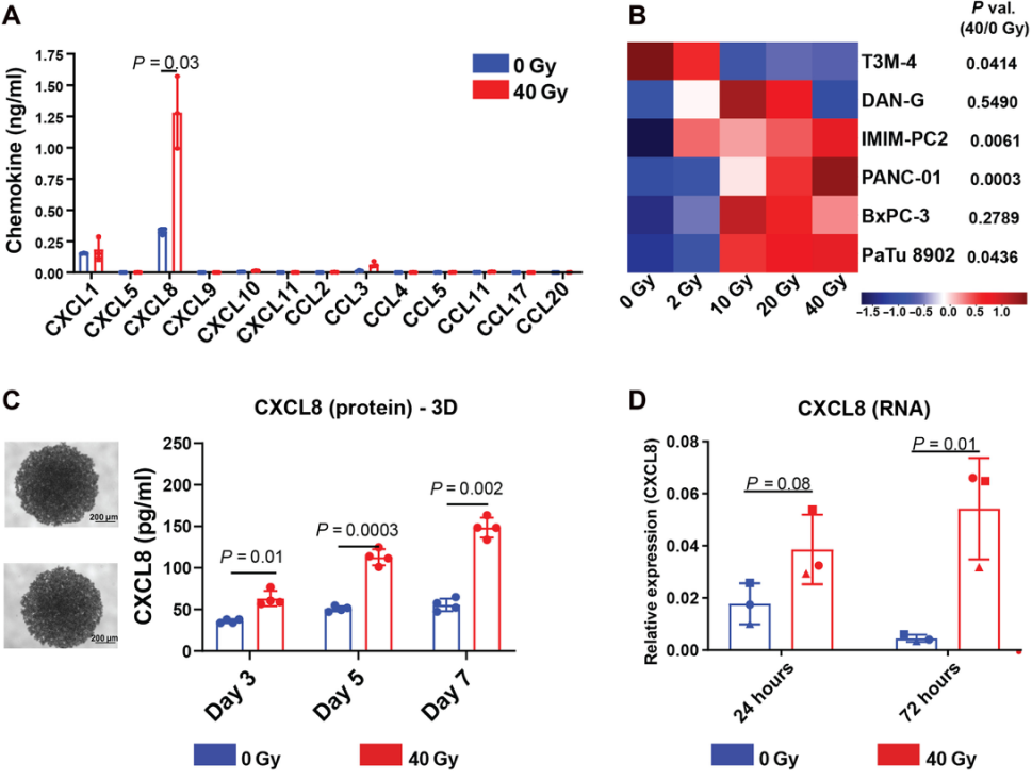
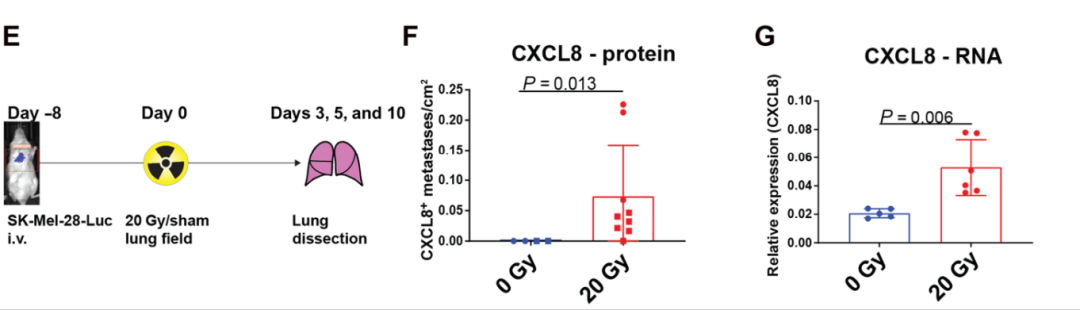
由此我们可以得出结论:辐射可以触发CXCL8释放和NK细胞向受辐射肿瘤迁移。
Fig 4辐射诱导肿瘤细胞衰老特征和NF-κB通路激活
为了进一步验证辐射对肿瘤细胞的影响,作者对肿瘤细胞进行处理后照射,发现辐射显著增加了衰老相关的β-半乳糖苷酶阳性肿瘤细胞的比例,且呈辐射剂量依赖性;在照射的第四天,作者发现辐射可诱导肿瘤细胞中p21的表达,使用免疫印迹法(WB)检测p65在亚细胞部分在SK-Mel-28细胞部分的表达,结果显示:核内p65的表达在肿瘤细胞照射后增加。

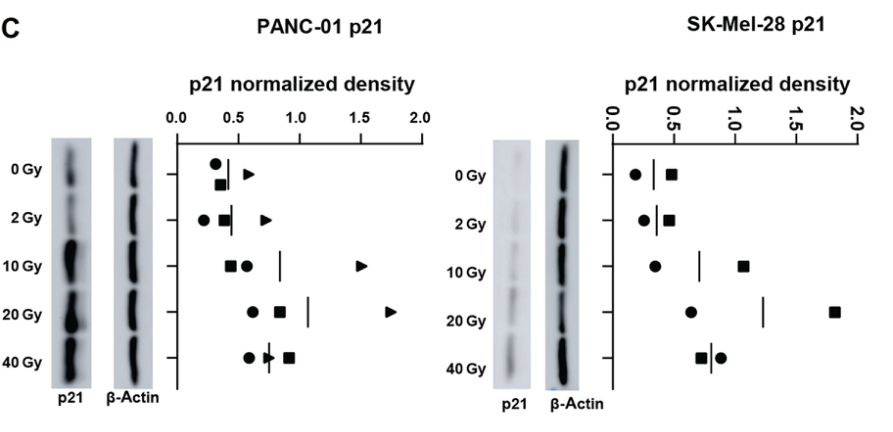
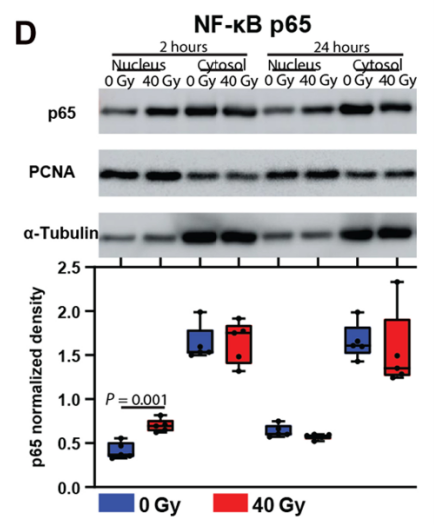
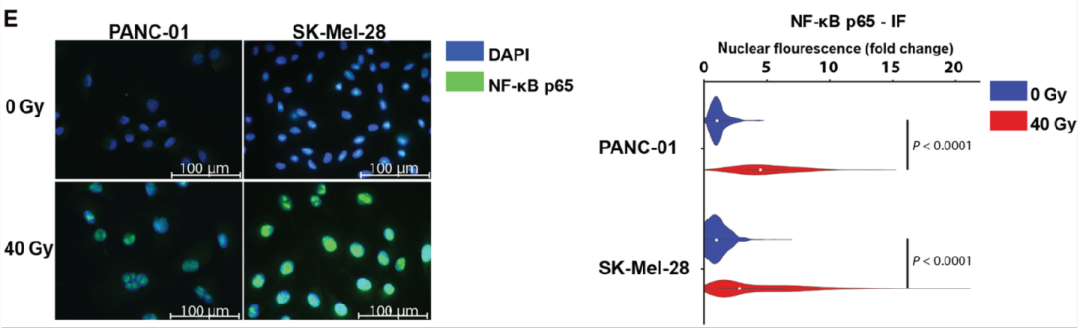
由此我们可以得知:辐射诱导肿瘤细胞衰老特征和NF-κB通路激活。
Fig 5NF-κB和mTOR参与了辐射诱导的CXCL8释放
为了探究辐射诱导CXCL8释放过程中的影响因素,作者进行了进一步实验。通过两天的40Gy照射,作者发现siRNA和基于CRISPR-Cas9的p65干扰均减弱了辐射对CXCL8的诱导作用。p65敲除pc-01球形体辐照的7天后,作者分别使用NF-kB抑制剂TPCA-1(如图C所示)和雷帕霉素(如图D所示)处理SK-Mel-28细胞条件培养基,发现NF-κB抑制剂TPCA-1抑制了辐射诱导的肿瘤细胞CXCL8释放,且雷帕霉素减少受辐射肿瘤细胞CXCL8的释放,抑制p70-S6激酶磷酸化,证实了其对mTOR的抑制作用,并增加了辐射中iκB-α水平,这说明它对NF-κB也有抑制作用。
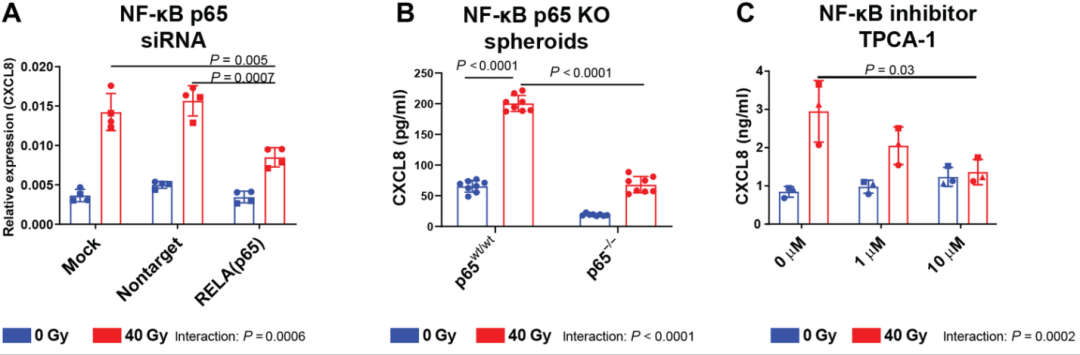
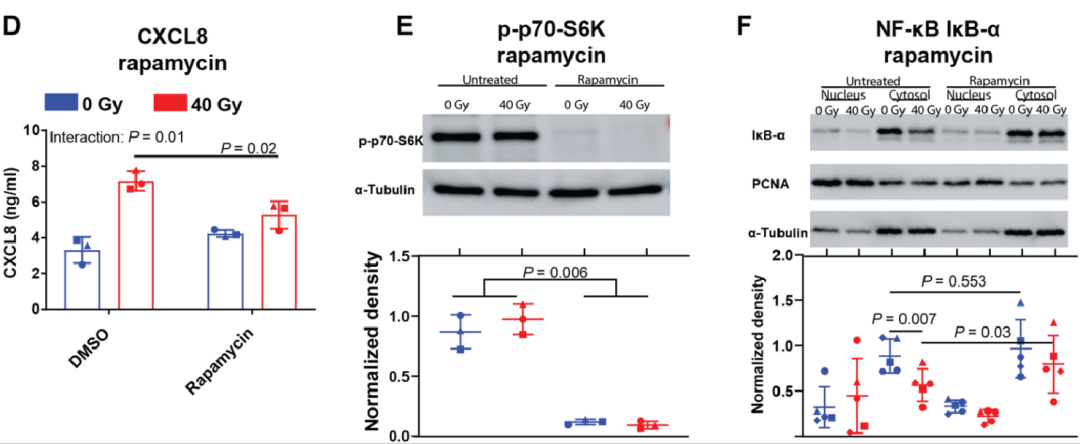
由此我们可以得知:NF-κB和mTOR参与了辐射诱导的CXCL8释放。
Fig 6NF-κB依赖的CXCL8释放介导了NK细胞向辐射肿瘤细胞的迁移
下面,我们继续来看PPT中的AB两张图,A图是新分离的原代人NK细胞表面趋化因子受体表达的点图,B图是新分离的原代人NK细胞表面的趋化因子受体表达(填充)或各自同型对照染色(阴影)的代表性直方图,通过这两张图,我们可以得知:CD56dim而不是CD56bright型人原代NK细胞表达CXCL8受体CXCR1和CXCR2;之后作者进行了不同的实验处理,用重组CXCL8体外处理激活的NK细胞,如图C所示,结果显示重组CXCL8在体外能吸引CD56dimNK细胞;再收集40Gy照射5天后不同肿瘤细胞系的培养基,如图D所示,得出辐射诱导NK细胞向3种肿瘤细胞系迁移,提示可溶性介质可调控辐射诱导的NK细胞迁移;图E则是收集CXCL8中和抗体处理或不处理的40gy照射的SK-Mel-28细胞条件生长培养基;发现CXCL8中和抗体降低了NK细胞向受辐射肿瘤细胞的迁移;图F表示收集40Gy照射(RT)或模拟照射(非RT)的p65wt/wt或p65−/−PANC-01球体。得出:基于CRISPR-Cas9的NF-κB p65敲除抑制了CD56dimNK细胞向肿瘤细胞球的迁移。
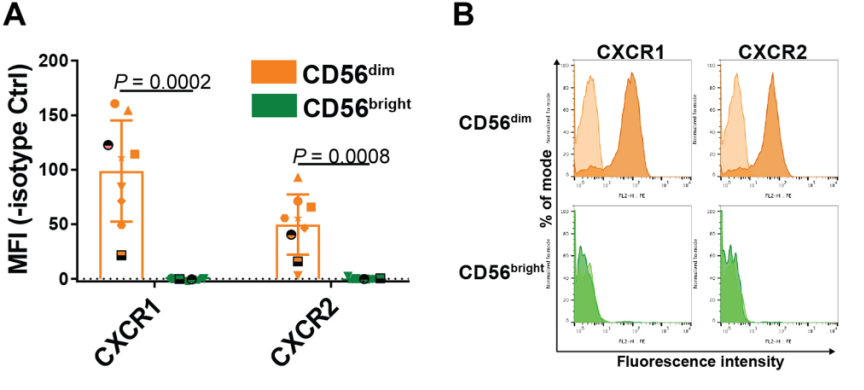
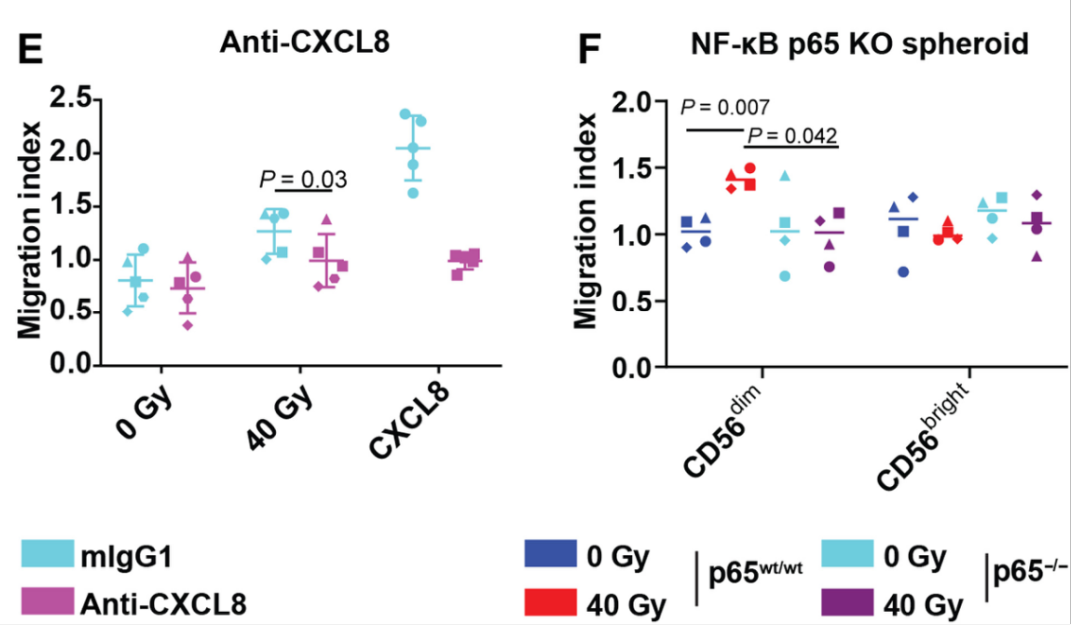
由此,我们可以得出:NF-κB依赖的CXCL8释放介导了NK细胞向辐射肿瘤细胞的迁移。
Fig 7联合照射和过继性NK细胞转移抑制小鼠肿瘤生长
最后,作者通过NK细胞过继转移和放疗的异种移植小鼠模型来测试联合NK细胞和辐射在肿瘤治疗中的作用。作者将PBS中的NK细胞分别与经10Gy照射和未照射的荧光素酶转导的肿瘤细胞SK-Mel-28静脉注射到NK细胞缺陷的NSG小鼠体内,如图A所示。接着作者在指定时间点测定肺内肿瘤负荷,结果显示单独放疗或NK细胞治疗可获得较强的肿瘤控制效果,且联合放疗和过继性NK细胞治疗可进一步降低所有动物的肿瘤负荷,随后作者又在NSG小鼠中过继性转移NK细胞和PANC-01细胞,发现虽然NK细胞和辐射可以降低肿瘤负荷,但是只有联合NK细胞和辐射才能实现持续的PANC-01肿瘤控制。
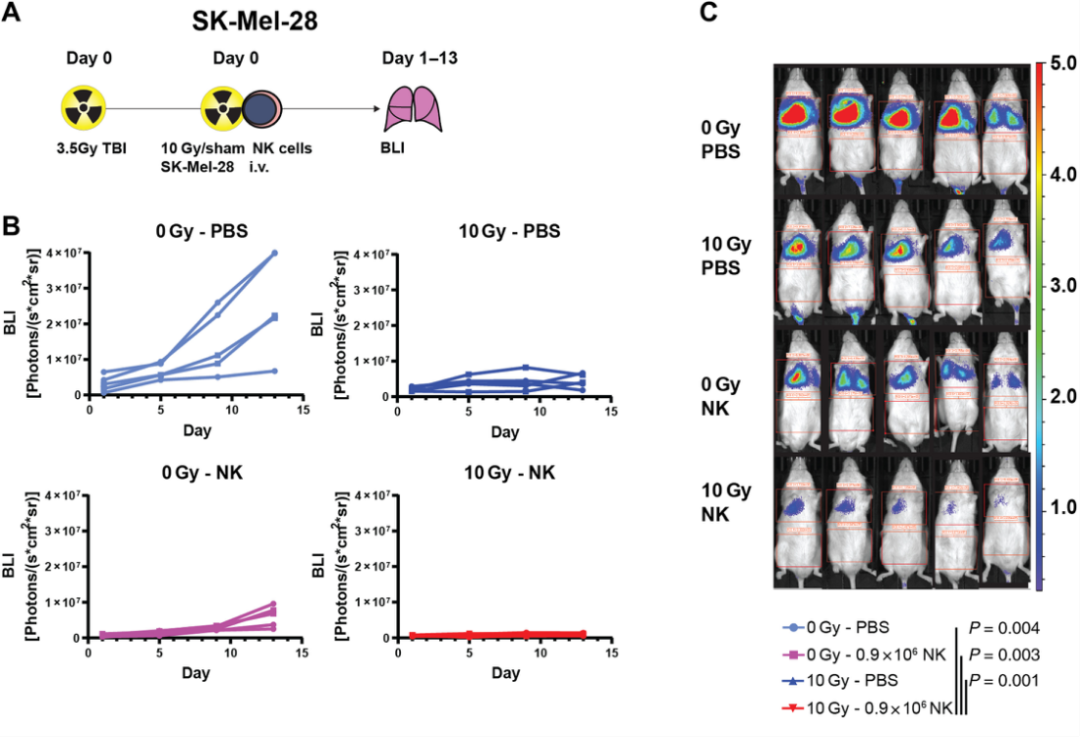
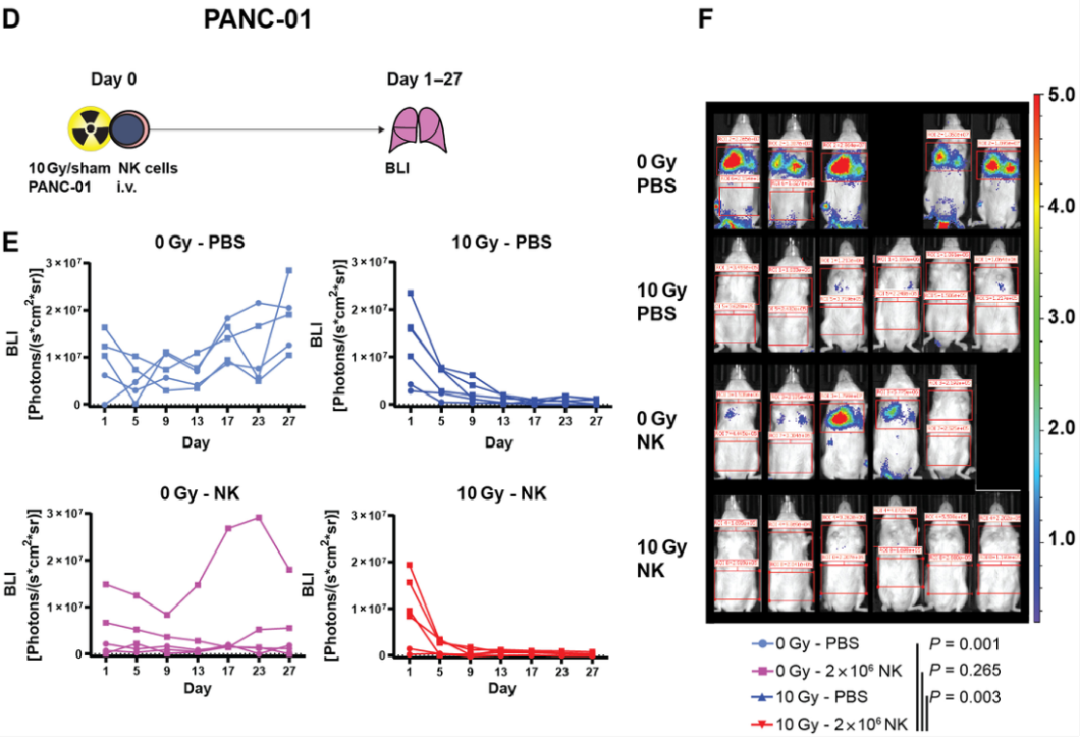
由此我们得知:联合照射和过继性NK细胞转移抑制小鼠肿瘤生长。
结论
作者将CXCL8诱导的固有免疫监视的机制与人类放疗抗肿瘤反应联系起来,表明放疗可能是一种增强NK细胞浸润的治疗策略,易应用于临床,尤其适用于治疗前NK细胞数量较高的患者。由此,可以得出如果结合NK细胞的疗法,如治疗性抗体或过继性NK细胞转移,就可进一步提高接受放射治疗的癌症患者的NK细胞抗肿瘤活性。
最后我们再来回顾一下作者的整个研究思路:作者首先在随机对照临床试验中研究了胰腺癌患者在RCTX联合ADCC介导的抗体西妥昔单抗治疗后的NK细胞反应,再利用实验系统探索原代人NK细胞向实体瘤迁移的机制,最后在异种移植小鼠中测试了联合过继NK细胞和化疗的治疗策略。
三、研究思路
读完这篇文章,大家对基于NK细胞抗肿瘤活性的课题思路有想法了吗?我们也给大家总结了比较常见的研究思路,主要可以分为以下四个步骤。
首先确定研究肿瘤类型;
然后检索文献明确已研究的NK细胞在目标肿瘤微环境中的作用及机制;
再基于感兴趣的分子机制探究某种药物或治疗策略是否可以增强NK细胞抗肿瘤活性;
最后基于研究目的及科学假设,设计课题实验方案,包括临床、体内、体外等等。
 文章推荐
文章推荐