
大家好,今天我们要讲解的内容是组蛋白的乳酸化修饰。我们将从四个方面来讲解:组蛋白乳酸化修饰的相关概念、作用,有关乳酸化的文献解析,以及最后的文献分享。
一、乳酸化的概念
乳酸是瓦尔堡效应期间产生的一种化合物,被广泛认为是能量来源和代谢副产品。正常细胞通过糖酵解、线粒体氧化磷酸化和磷酸戊糖途径代谢葡萄糖。在有氧条件下,糖酵解产生的丙酮酸通过氧化磷酸化产生二氧化碳和氧气。在缺氧条件下,葡萄糖可以通过糖酵解分解代谢成两个丙酮酸分子,同时产生两个三磷酸腺苷(ATP)和烟酰胺腺嘌呤二核苷酸(NADH)分子。在糖酵解过程中,NADH和丙酮酸被还原为乳酸然后排泄,最后,每个葡萄糖分子在不消耗氧气的情况下产生两个ATP分子和两个乳酸分子。
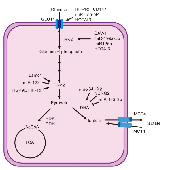
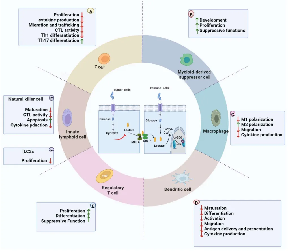
乳酸的积累促进了组蛋白赖氨酸发生乳酸化修饰。而乳酸衍生的组蛋白赖氨酸乳酸化(Kla),作为一种新的表观遗传学修饰,直接刺激染色质的基因转录。乳酸化修饰同时也是乳酸发挥功能的重要方式,参与糖酵解相关细胞功能、巨噬细胞极化、血管功能、线粒体、神经系统调控等重要生命活动,为肿瘤、免疫等领域的研究指明新方向。
二、乳酸化的常用检测手段
常用于检测乳酸化的手段有HPLC-MS/MS液质联用、Anti-Kla免疫印迹。

三、乳酸化的作用
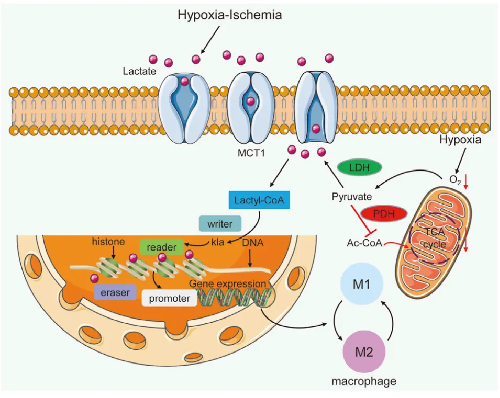
1.乳酸作为巨噬细胞中的信号分子,触发组蛋白赖氨酸乳酸化引起的表观遗传学变化。
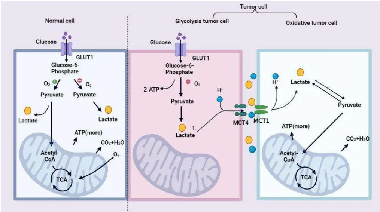
2.乳酸在肿瘤细胞中和正常细胞中有着不同的代谢方式。葡萄糖代谢主要包括线粒体中的糖酵解和三羧酸(TCA)循环。正常细胞在氧气充足条件下,主要通过TCA循环产生能量,在缺氧条件下,会产生大量的乳酸。而肿瘤细胞糖酵解会产生大量的乳酸盐,这些乳酸盐通过单羧酸转运蛋白4(MCT4)转运到肿瘤微环境(TME)中。然后,乳酸可以以单羧酸转运蛋白1(MCT1)为燃料转运到氧化性肿瘤细胞中,并通过氧化磷酸化产生能量。
3.乳酸-乳酸化对TME免疫系统形成抑制性调节网络。在TME中,肿瘤细胞消耗大部分营养分泌过量的乳酸,导致酸中毒、血管生成和免疫抑制。乳酸还通过抑制CD8+T细胞、自然杀伤细胞(NK)、自然杀伤T细胞(NKT)、树突状细胞和巨噬细胞的功能来调节先天和适应性免疫细胞的代谢。与之相反的是,乳酸有利于调节性T(Treg)细胞和骨髓源性骨髓抑制细胞(MDSCs)在酸性环境中维持其免疫抑制功能。
四、乳酸化的文献解析
这是一篇发表于2022年,中科院二区,影响因子为9.2的文献,名为“丙酮酸激酶2(PKM2)的乳酸化抑制促炎巨噬细胞的炎症代谢适应”,这篇文献阐明了PKM2的乳酸化修饰在调节促炎巨噬细胞炎症代谢适应中的潜在作用。

丙酮酸激酶(PK)是糖酵解最终步骤的限速酶,PKM2则是PK的4种同工酶的其中一种,且在癌细胞糖代谢过程中发挥关键性作用,可通过一种非代谢机制促进细胞增殖和肿瘤形成。
01 PKM2调节LPS诱导的巨噬细胞的糖酵解
首先作者对PKM2能否调节脂多糖(LPS)诱导的巨噬细胞中的糖酵解做出了研究。
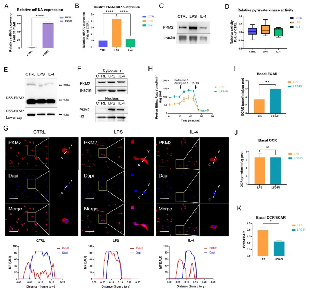
已知免疫细胞优先表达由PKM基因24的可变剪接产生的两种丙酮酸激酶亚型PKM1和PKM2。PKM2的mRNA在幼稚原代巨噬细胞(BMDM细胞)中的表达显著高于PKM1的表达(图A)。此外,作者检测了不同细胞中两种丙酮酸激酶亚型表达相关的蛋白质水平,结果显示PKM2水平显著高于幼稚BMDM细胞中的PKM1水平。这些事实证实PKM2在BMDM细胞中比PKM1表达更丰富。且在100ng/ml LPS孵育24小时后,PKM2的mRNA表达和蛋白质水平显著增加,明显高于25ng/ml白细胞介素4(IL-4)诱导的巨噬细胞(图B、C)。
虽然LPS诱导的巨噬细胞PKM2蛋白水平显著高于幼稚和IL-4诱导的巨噬细胞,但丙酮酸激酶活性没有显著差异(图D)。且BMDM细胞裂解物的双琥珀酰亚胺辛二酸酯(DSS)交联表明,LPS诱导的巨噬细胞中PKM2四聚体形式(240KD)的水平明显低于IL-4诱导的巨噬细胞(图E)。与四聚体形式的PKM2相比,二聚体/单体形式可以进入细胞核,因此作者评估了PKM2的亚细胞定位,我们可以看到LPS导致细胞核中PKM2的表达增加(图F)。接着,作者通过免疫荧光观察到LPS诱导的巨噬细胞细胞核中PKM2的水平显著高于幼稚和IL-4诱导的巨噬细胞(图G)。这些结果表明PKM2在LPS诱导的巨噬细胞中过表达,但在幼稚和IL-4诱导的巨噬细胞中无活性。
接下来,作者对降低PKM2丙酮酸激酶活性会对LPS孵育的BMDM细胞的细胞外酸化率(ECAR)(代表糖酵解水平)和细胞耗氧率(OCR)(代表氧化磷酸化水平)产生怎样的的影响做出了研究。结果显示:PKM2酶抑制剂导致糖酵解速率显著增加(图H、图I),但不会导致LPS孵育的巨噬细胞中OCR的变化(图J)。且基础OCR:ECAR比率表明,降低PKM2丙酮酸激酶活性可诱导LPS孵育的巨噬细胞糖酵解水平上调(图K)。
02 乳酸在LPS诱导的巨噬细胞中激活PKM2
第一部分的实验结果验证了PKM2可调控糖酵解和乳酸生成;然而,乳酸是否调节PKM2仍不清楚。
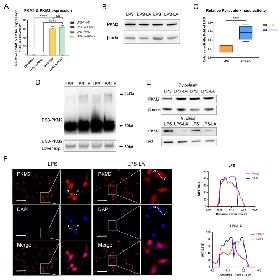
因此,作者首先检测了乳酸对BMDM细胞中PKM2的mRNA表达和蛋白水平的影响。结果显示:外源性乳酸(20mM)的干预既没有改变LPS诱导的巨噬细胞中PKM2的mRNA表达(图A),也没有改变PKM2蛋白水平(图B)。乳酸显著促进LPS诱导的巨噬细胞的丙酮酸激酶活性(图C)。BMDM细胞裂解物的DSS交联表明LPS-LA组中PKM2四聚体形式(240KD)的水平明显高于LPS组(图D)。且免疫荧光结果证实:LPS-LA组细胞核中的PKM2水平明显低于LPS组(图E、F)。
这些结果表明乳酸激活LPS诱导的巨噬细胞中的PKM2。
03 乳酸抑制糖酵解,并通过激活PKM2促进LPS诱导的巨噬细胞向修复表型的转变
接下来,作者检测了乳酸对LPS诱导的巨噬细胞ECAR和OCR水平的影响。
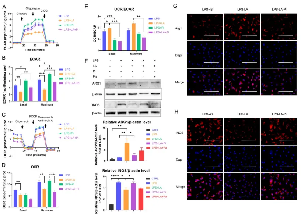
研究显示,乳酸显著降低了LPS孵育的巨噬细胞中的ECAR水平,PKM2酶抑制剂显着增加了ECAR水平(图A、B)。此外,作者观察到乳酸降低了OCR水平,PKM2酶抑制剂没有改变OCR水平(图C、D)。总的来说,乳酸导致巨噬细胞的OCR:ECAR比值显著上调,而PKM2酶抑制剂会降低OCR:ECAR比值(图E)。值得注意的是,PKM2酶抑制剂逆转了乳酸的作用。此外,与LPS+LA组相比,LPS+LA+Pi组显示出更高的ECAR水平(图A、B)和更低的OCR:ECAR比率(图E)。这些结果表明,乳酸可能通过激活PKM2损害LPS诱导的巨噬细胞的炎症代谢适应。
既往研究验证了与促炎基因iNOS表达减少和组织修复基因ARG1表达增加相关的巨噬细胞表型的时间依赖性变化,以及巨噬细胞可以从促炎表型转变为修复表型且抑制糖酵解或乳酸可以刺激巨噬细胞的这种转变。因此,作者进一步分析了乳酸是否通过激活PKM2促进LPS诱导的巨噬细胞向修复表型的转变。在BMDM细胞中,LPS孵育后48小时(100ng/ml LPS),乳酸增加了M2巨噬细胞标志(ARG1)水平但降低了M1巨噬细胞标志iNOS(iNOS)水平(图F、图G、图H)。这些结果支持了乳酸通过激活PKM2部分促进LPS诱导的巨噬细胞向M2巨噬细胞极化的理论。
由此我们可以得出:乳酸可以抑制LPS诱导的巨噬细胞中的糖酵解。
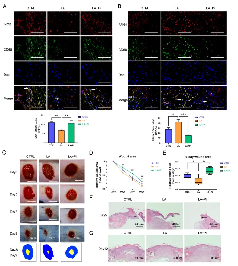
04 乳酸通过激活 PKM2 促进伤口巨噬细胞向修复表型的转变并加速小鼠伤口愈合
巨噬细胞从促炎表型到修复表型的转变在伤口愈合中起着至关重要的作用。许多研究已经刺激巨噬细胞向修复表型极化,以获得更好的伤口愈合结果。
在这一步的实验中,作者使用小鼠构建了一个皮肤伤口模型,以测试乳酸是否促进伤口巨噬细胞从促炎表型转变为修复表型,并通过激活PKM2加速伤口愈合。
作者在促炎性巨噬细胞受伤后第3天和第5天局部给予外源性乳酸(20mM)。结果显示:LA组创面组织中促炎性巨噬细胞(iNOS+CD68+阳性细胞)的数量明显低于CTRL组,而修复性巨噬细胞(ARG1+CD68+阳性细胞)水平高于CTRL组(图A、B)。受伤后第5天,与LA组相比,在LA+Pi组中,促炎性巨噬细胞数量较高(图A),而修复性巨噬细胞数量较低(图B)。
愈合伤口照片显示,LA组小鼠的伤口愈合速度明显快于CTRL组,而LA+Pi组的伤口愈合速度明显慢于LA组(图C、D)。伤后第9天,LA组的伤口面积明显小于CTRL组,而LA+Pi组的伤口面积明显比LA组更大更广泛(图E)。
此外,伤后第5天的伤口再上皮化也验证了创面愈合的速度。LA组迁移上皮舌的长度明显长于CTRL组,而LA+Pi组的长度明显短于LA组(图F)。在受伤后第12天,三组之间的皮肤质量没有显着差异(图G),说明乳酸干预并没有降低伤口的愈合质量。这些结果表明,在小鼠中,局部施用外源性乳酸可促进伤口巨噬细胞从促炎表型转变为修复表型,并通过促进PKM2丙酮酸激酶活性来加速伤口愈合。
由此我们可以得出结论:乳酸能激活PKM2,并上调M2巨噬细胞水平。
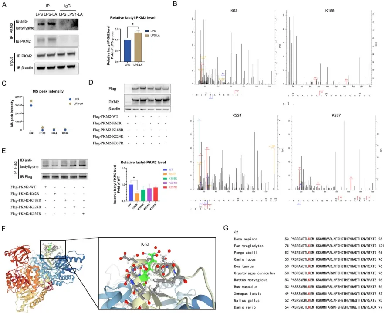
05 乳酸促进PKM2的K62乳酸化
在得知乳酸能激活PKM2后,作者进一步探索了潜在的机制。
大量研究表明,蛋白质的翻译后修饰(PTM)在PKM2的功能调节中起着核心作用。作为一种潜在的修饰底物,最近有报道称乳酸可以直接修饰蛋白质。目前尚不清楚PKM2的乳酸化修饰是否存在以及乳酸化修饰如何调节PKM2的功能。
在LPS诱导的BMDM细胞中,作者使用PKM2抗体下拉PKM2,并使用抗乳酸赖氨酸抗体检测PKM2乳酸化水平,观察到PKM2被乳酸化修饰,并在用20mM乳酸处理24小时后显著增强(图A)。接下来,作者通过IP质谱分析检测了LPS诱导和LPS+LA诱导的BMDM细胞中PKM2可能的乳酰化位点。
作者注意到在乳酸干预后MS峰强度增加最显著的四个位点,即K62、K188、K224和K337(图B、C),这表明这些位点对乳酸孵育更敏感。然后,通过过表达质粒在293T细胞中异位过表达PKM2,作者构建了K62R、K188R、K224R和K337R位点突变或WT PKM2过表达293T细胞。与对照组相比,PKM2过表达细胞中PKM2水平显著上调(图D)。接下来,作者使用标记抗体下拉PKM2来检测乳酸化水平。结果证实,K62R位点突变显著降低了PKM2乳酸化,而其他三个位点突变对乳酸化水平没有显著影响(图E)。这些结果表明K62位点是PKM2的主要乳酸化位点。PKM2的三级结构显示K62位于PKM2蛋白的A结构域(图F),并且与关键的活性位点S362相邻。且K62在从斑马鱼到各种哺乳动物的物种中是保守的(图G)。这些事实也支持了K62位点是PKM2功能的潜在调节位点的假设。
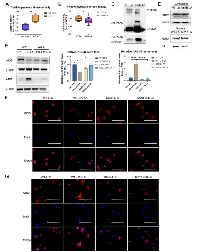
06 K62R突变体逆转了乳酸对PKM2丙酮酸激酶活性和巨噬细胞表型转变的调节
最后作者进一步评估了K62位点乳酸化对PKM2功能的调节作用。结果显示,乳酸孵育显著促进WT PKM2过表达293T细胞中的PKM2酶活性(图A)。乳酸孵育后,K62R突变显著抑制293T细胞中的PKM2酶活性(图B)。乳酸孵育的293T细胞裂解物的DSS交联表明,K62R-LA组中PKM2四聚体形式(240KD)的水平明显低于WT-LA组(图C)。此外,在乳酸处理的293T细胞中,K62R-LA组细胞核中PKM2的水平约为WT-LA组的1.41倍(图D)。这些结果证实了K62位点对PKM2的功能有显著影响,并表明乳酸通过K62位点的乳酸化促进PKM2酶的活性。
接下来,作者使用慢病毒载体在BMDM细胞中过表达K62R突变或WT PKM2。LPS孵育48小时后,乳酸增加了ARG1水平但降低了WT BMDM细胞中的iNOS水平(图E-G)。乳酸的这种作用在K62R突变BMDM细胞中显著减弱。与WT-LPS-LA组相比,K62R-LPS-LA组显示出更高的iNOS水平和更低的ARG1水平(图E-G)。这些结果支持乳酸通过K62位点PKM2的乳酸化,部分促进了LPS诱导的巨噬细胞向修复表型转变的结论。
由此我们知道:作者通过将K62位点突变,发现乳酸的作用消失,表明乳酸是通过对PKM2的K62位点进行乳酸化修饰发挥作用。
这篇研究证明了PKM2在促炎性巨噬细胞代谢适应和表型转化中具有重要调控作用,并首次发现PKM2存在乳酸化修饰、第62位赖氨酸位点为其主要的乳酸化修饰位点,乳酸化修饰可增强PKM2的丙酮酸激酶活性、抑制M1巨噬细胞糖酵解、促进促炎表型巨噬细胞向修复表型转变。
最后我们来总结一下乳酸化的研究思路吧~
因为乳酸与乳酸化修饰存在直接关联,所以我们可以从糖酵解入手,引出乳酸化修饰。再通过常用的乳酸化检测手段,比如HPLC-MS/MS液质联用,Anti-Kla免疫印迹等来解释乳酸化的过程,也可以用同位素C标记乳酸化代谢过程。
 文章推荐
文章推荐