
代谢重编程与疾病发生发展紧密相关,其相关信号通路上的关键蛋白可作为药物靶点。近几年,代谢重编程相关研究的高分文章大量涌现。且在国自然基金资助项目中,代谢重编程项目比例也呈快速增长的趋势。
下面小编将以一篇高分文献为例,带领大家一起深入了解糖代谢重编程的课题设计思路~

【文章题目】:TRPM7沉默调节葡萄糖代谢重编程通过激活AMPK促进HIF-1α降解抑制卵巢癌生长
【发表期刊】:Journal of Experimental & Clinical Cancer Research
【影响因子】:IF=11.3
【发表日期】:2022.1
一、研究摘要
研究背景:卵巢癌是常见的妇科恶性肿瘤,流行率和发病率高,影响许多妇女的身体健康。标准治疗方法包括手术切除和化疗,但5年生存率仍为50%。因此,研究卵巢癌的分子发病机制、新的预后生物标志物和治疗靶点对预后和治疗至关重要。
前期基础:
1. TRPM7表达上调与人卵巢癌盆腔淋巴结转移和预后不良有关,抑制TRPM7可通过减弱Ca2+-PI3K/AKT信号通路来抑制卵巢癌细胞的侵袭和转移。
2. TRPM7在多种肿瘤中表达上调,可增强癌细胞的恶性行为。
3. 抑制TRPM7可促进前列腺癌细胞中HIF-1α的降解。而HIF-1α/AMPK信号通路是参与糖酵解和氧化磷酸化(OXPHOS)的主要调节因子。
因此,作者推测TRPM7激活可能调节HIF-1α/AMPK信号通路,调节葡萄糖代谢,促进癌细胞增殖。
二、研究思路
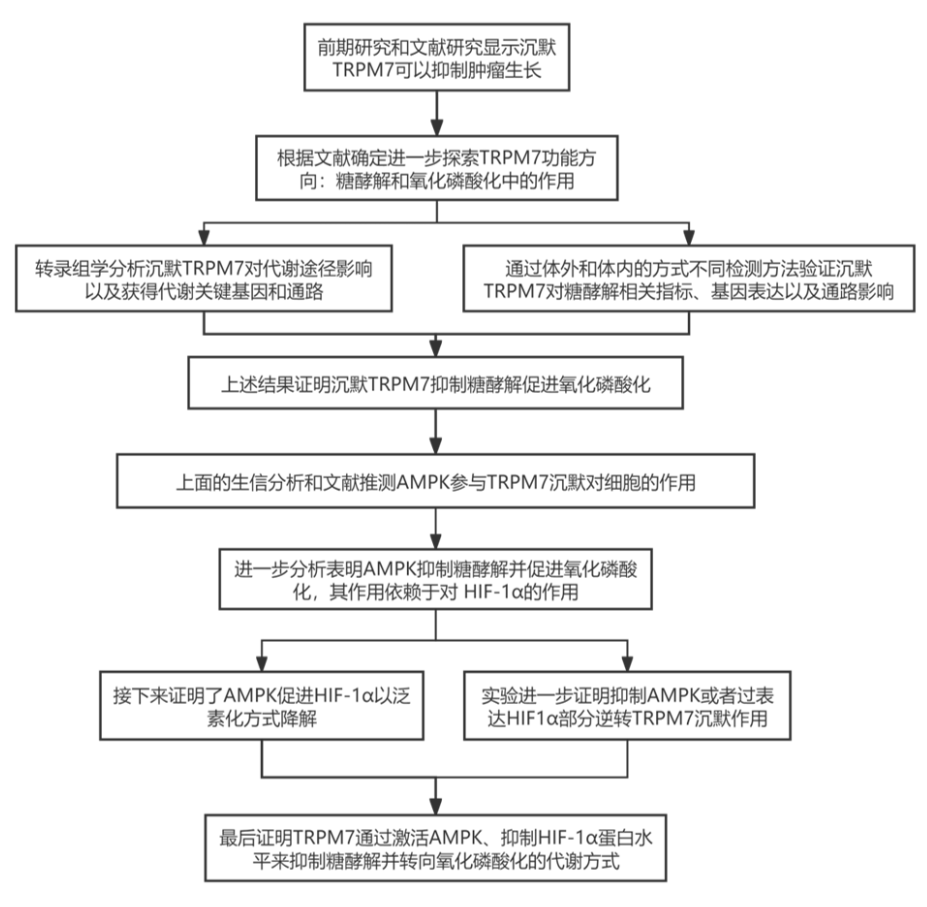
三、研究结果
1. TRPI7沉默通过改变葡萄糖代谢重编程来减弱卵巢癌的生长
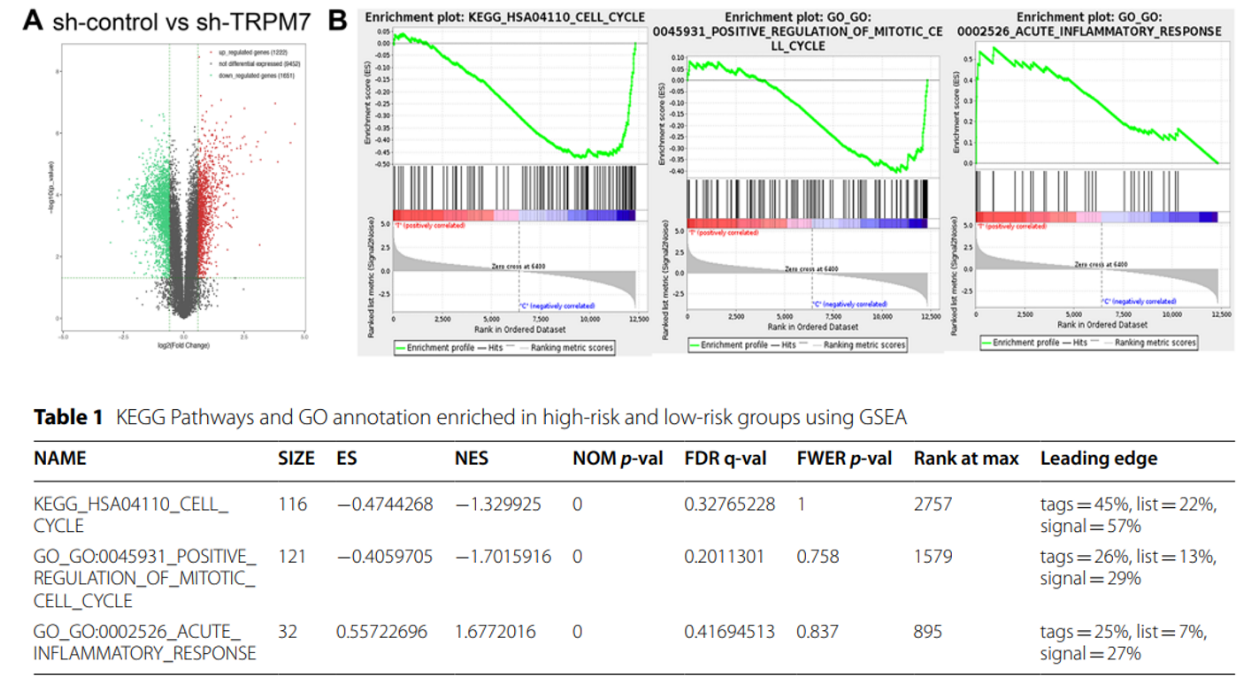
为了了解TRPM7沉默如何调节卵巢癌细胞中的基因表达,作者沉默了卵巢癌细胞SKOV3中的TRPI7,并进行了RNA-seq分析。图1A是生信分析中的常见的火山图,它描述的是两组数据的一个差异基因分析结果。图1B是将这些差异基因分成高风险和低风险组,使用基因集富集分析(GSEA)进行KEGG和GO分析。表1是这两个分析结果的一个统计,结果表明差异表达基因(DEGs)参与了卵巢癌细胞周期、有丝分裂细胞周期的正调节和急性炎症反应的过程。
为了测试TRPM7沉默的功能结果,作者用EdU法量化了不同组卵巢癌细胞的增殖。如图1C所示,TRPM7沉默的SKOV3或HO8910细胞中EdU+细胞的数量少于对照组。此外,图1D显示,TRPM7沉默显著降低小鼠SKOV3肿瘤异种移植瘤的肿瘤大小和重量。
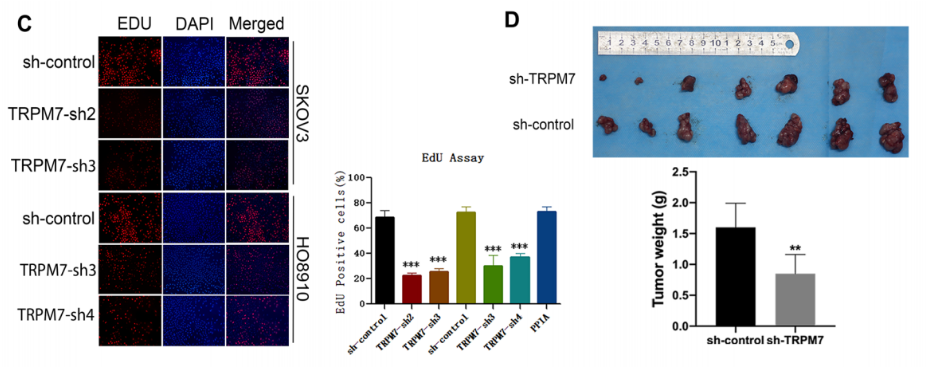
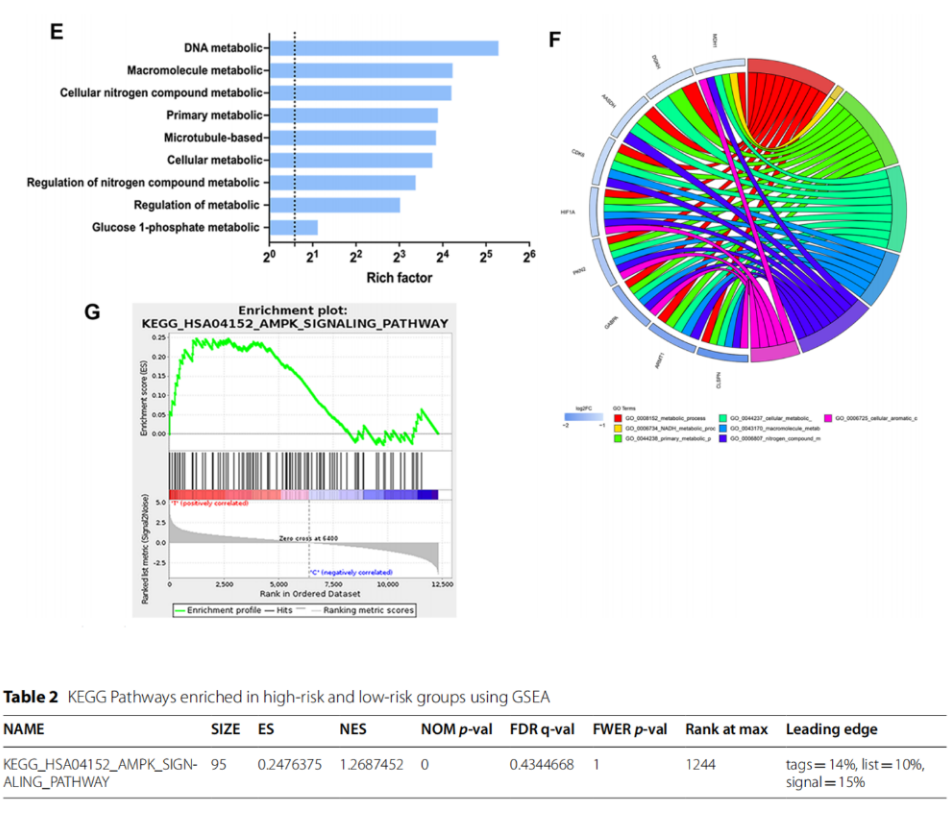
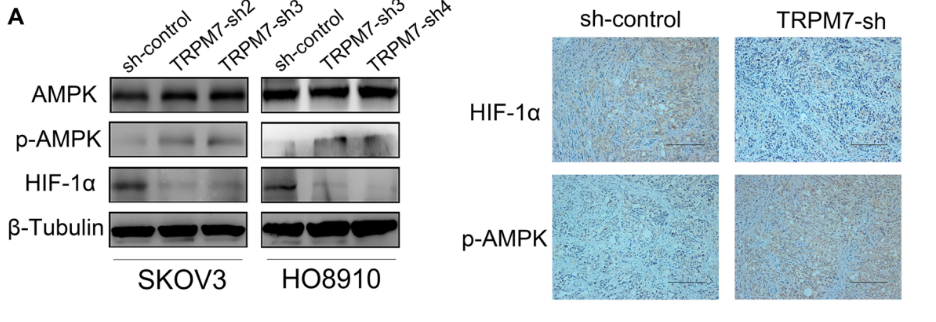
图1F显示许多DEGs参与调控糖酵解和OXPHOS,包括糖酵解相关的PDK1、HK2等和OXPHOS相关的IDH3B、UQCRC1等,并且TRPM7沉默也会下调HIF-1α在SKOV3细胞中的表达。图1G和表2中GSEA分析进一步揭示了潜在的信号通路,如AMPK信号通路在TRPM7沉默的SKOV3细胞中富集。据此,作者推测TRPM7沉默可能通过改变代谢重编程来抑制卵巢癌细胞的增殖。
2. TRPM7沉默将卵巢癌细胞的代谢重编程转变为OXPHOS
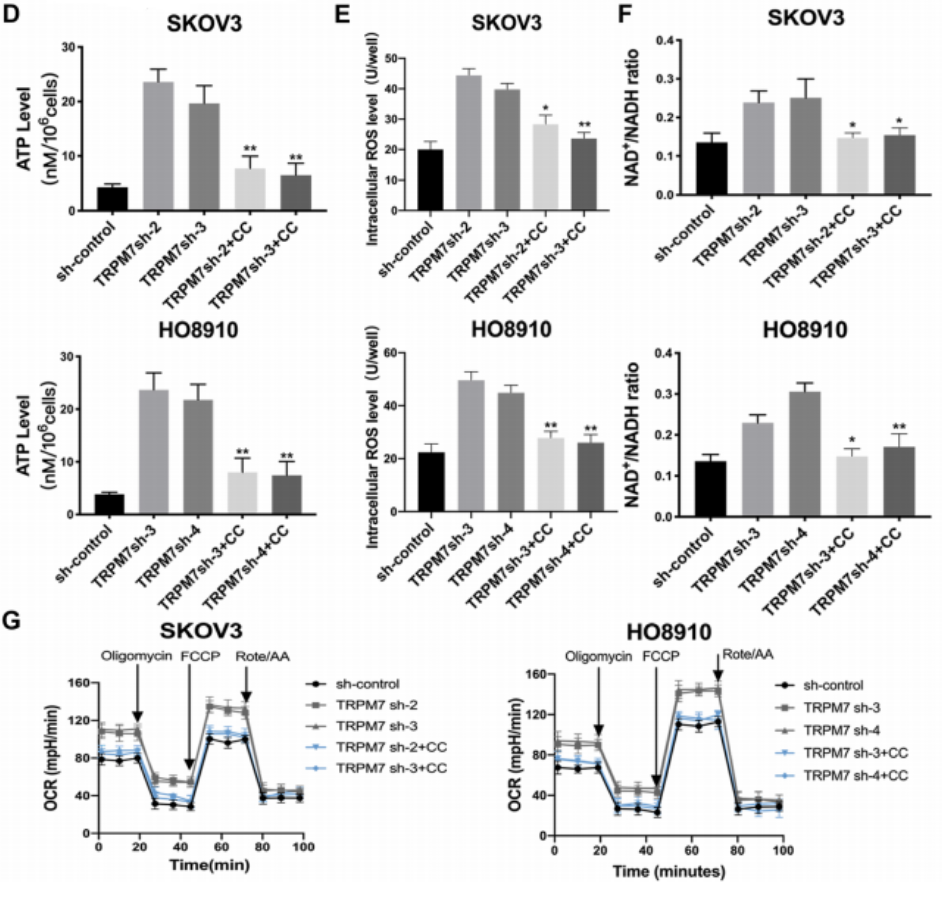
图2A~G表示TRPM7沉默对(A)细胞中葡萄糖摄取水平、(B)细胞外乳酸水平、(C)细胞外酸化率(ECARs)、(D)耗氧率(OCRs)、(E)NAD+/NADH比值、(F)ATP水平、(G)细胞内ROS水平的影响。结果表明,沉默TRPM7抑制糖酵解。
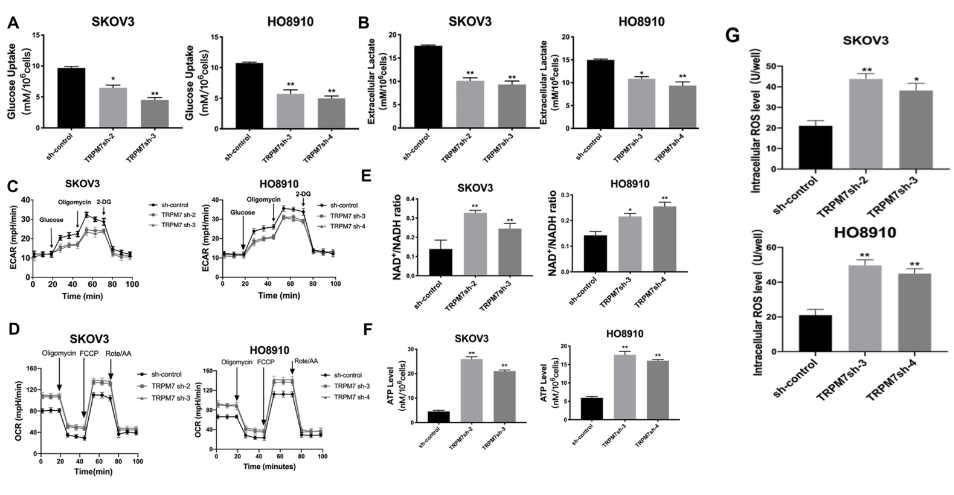
图2H是细胞移植瘤中TRPM7表达的免疫组织化学(IHC)分析结果,结果显示TRPM7抑制剂——香芹醛(CC)降低了SKOV3细胞中TRPM7的表达。图2I是用CC治疗对小鼠移植瘤影响的F-FDG PET/CT扫描影像图。下面两个柱状图是这个影像图的数值统计结果,结果显示,CC治疗不仅缩小了肿瘤大小,而且通过显著降低平均标准摄取值和总体积,降低了荷瘤小鼠的18F-FDG摄取。这些结果表明,TRPM7沉默将卵巢癌中的糖酵解转变为OXPHOS,从而抑制卵巢癌的生长。
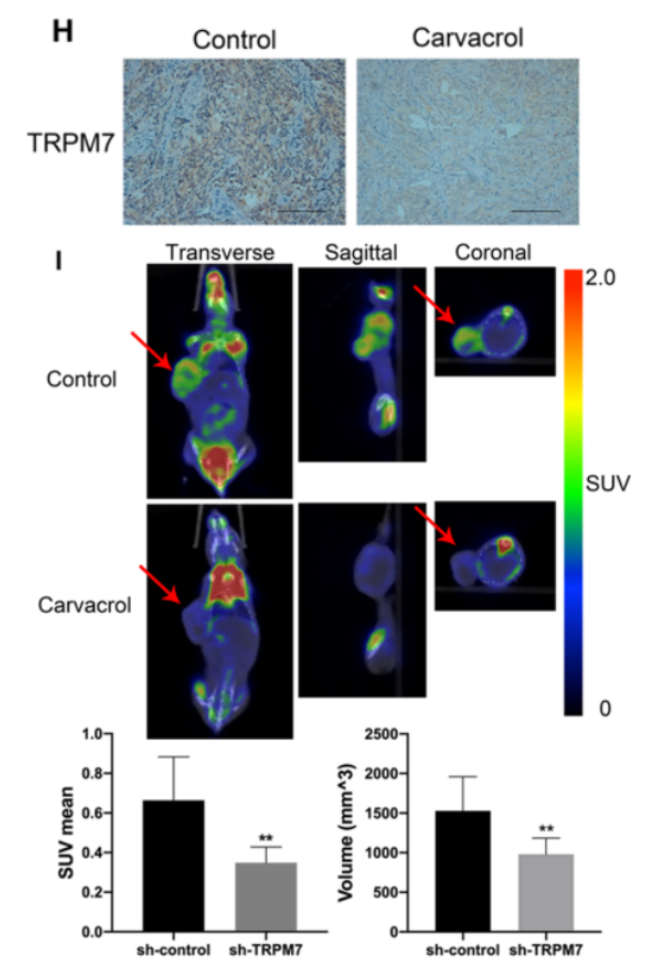
3. TRPM7沉默可减弱卵巢癌细胞的糖酵解过程并增强OXPHOS过程
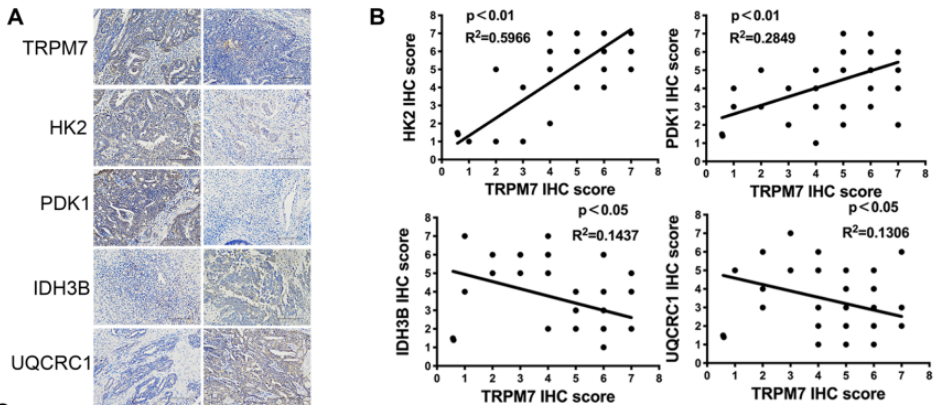
为了了解TRPM7如何调节卵巢癌的代谢重编程,作者对60例卵巢癌组织进行了IHC分析。图3A~B结果显示,TRPM7在卵巢癌组织中的表达水平与HK2、PDK1呈正相关,而与IDH3B、UQCRC1呈负相关,这佐证了TRPM7促进卵巢癌糖酵解的观点。
在图3C~E中,作者采用RT-qPCR、Western blot、免疫荧光检测分析了HK2、PDK1、IDH3B和UQCRC1在细胞中的表达水平,结果显示沉默TRPM7抑制HK2、PDK1表达,促进IDH3B和UQCRC1表达。
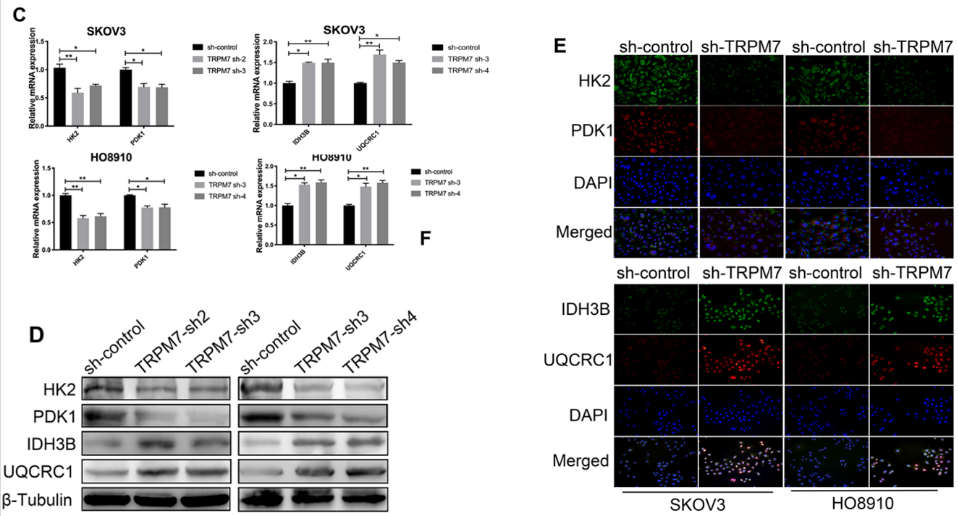
PKM2是糖酵解的关键酶,其核易位与肿瘤细胞的恶性行为有关。为了测试PKM2的重要性,我们对PKM2的细胞内分布进行了表征,图3F显示TRPM7沉默明显降低了SKOV3和HO8910细胞中核PKM2的水平,但增加了其细胞质PKM2的水平。此外,图3G显示,在TRPM7沉默的SKOV3肿瘤中,HK2和PDK1蛋白水平降低,但IDH3B和UQCRC1表达水平升高。综上,TRPM7沉默调节了卵巢癌中糖酵解和OXPHOS相关酶的表达水平,将糖酵解转化为OXPHOS。
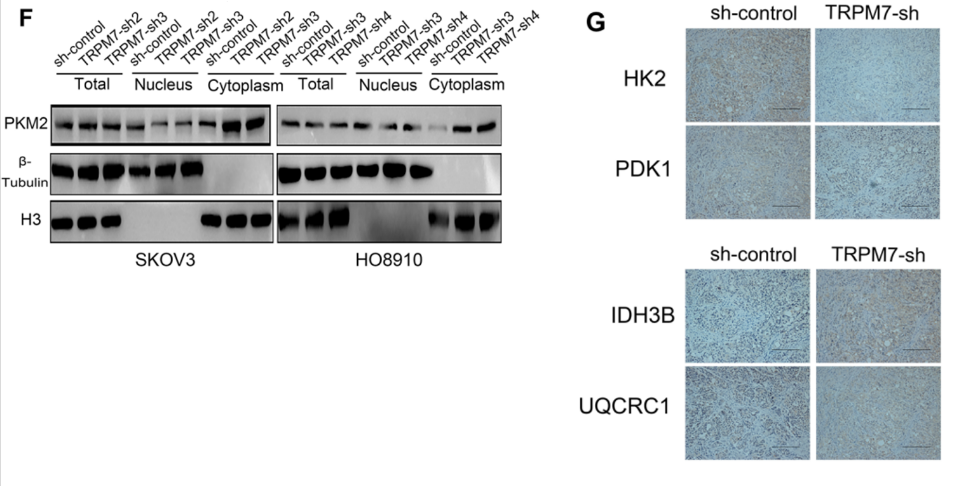
4. AMPK信号通路的激活抑制糖酵解,而糖酵解依赖于卵巢癌细胞中高水平的HIF-1α
已知在缺氧条件下,AMPK激活可以通过下调肿瘤细胞中促进糖酵解的HIF-1α的功能来促进OXPHOS,以此抑制糖酵解。为了了解TRPM7沉默如何调节HIF-1α和AMPK信号传导,作者通过WB和IHC检测了卵巢癌细胞中HIF-1α和AMPK的表达和激活水平。图4A显示,TRPM7沉默提高了AMPK磷酸化的相对水平,但降低了SKOV3和HO8910细胞以及SKOV3肿瘤中HIF-1α的表达。
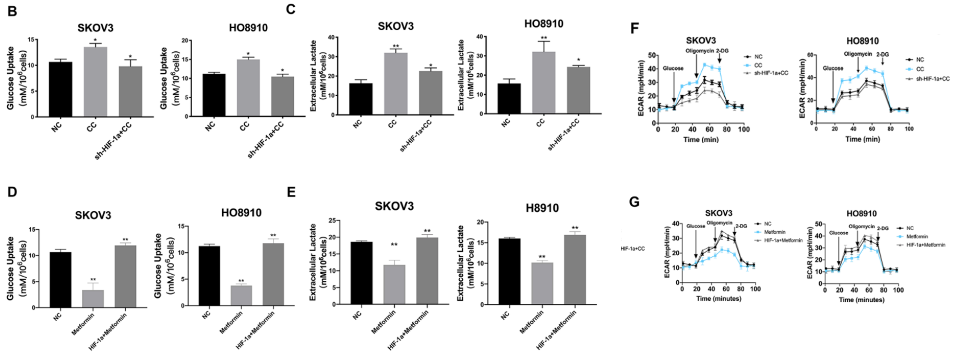
为了进一步了解AMPK激活在糖酵解向OXPHOS转变中的重要性,作者测试了AMPK激活改变对卵巢癌细胞中HIF-1α调节的糖酵解的影响。他们先建立了稳定的HIF-1α沉默SKOV3和HO8910细胞。图4B、C和F显示,与对照细胞相比,AMPK抑制剂CC增加了SKOV3和HO8910细胞的葡萄糖摄取、乳酸生成和ECAR,而在HIF-1α沉默的SKOV3和HO8910细胞中,这些作用被显著减轻或消除。然而图4D、E和G显示,AMPK的一种激活剂——二甲双胍显著降低了SKOV3和HO8910细胞的葡萄糖摄取、乳酸生成和ECAR。这两条证据表明,AMPK激活抑制糖酵解,而糖酵解依赖于卵巢癌中HIF-1α的高水平存在。
5. AMPK激活或HIF-1α过表达可减轻卵巢癌细胞中TRPM7沉默抑制的糖酵解
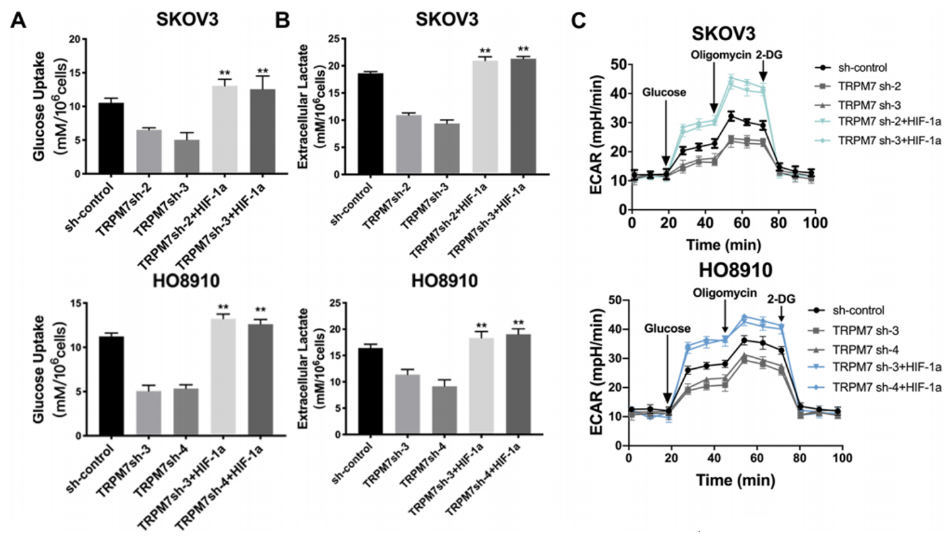
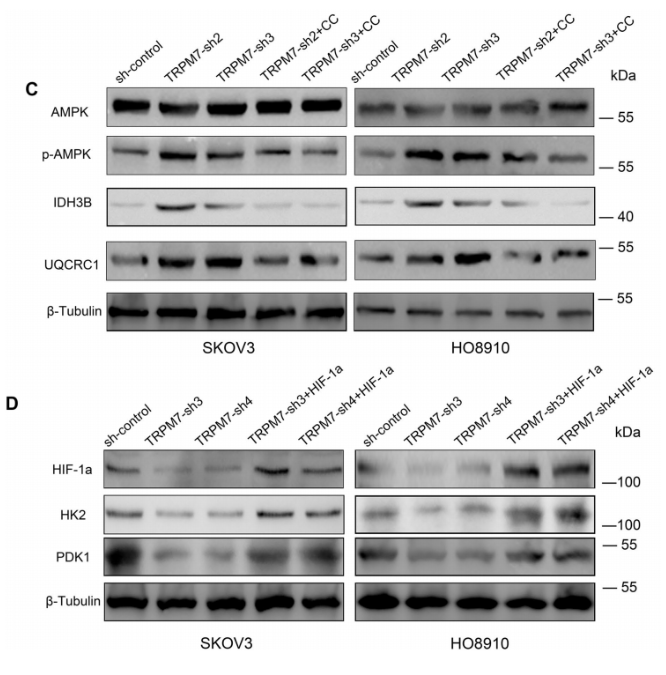
为了了解HIF-1α和AMPK活化如何调节TRPM7沉默诱导的卵巢癌细胞代谢重编程,作者首先在TRPM7沉默的卵巢癌细胞中产生HIF-1α过表达。其次,测试了TRPM7沉默对SKOV3和HO8910细胞中HIF-1α介导的糖酵解的影响。图5A~C显示,与对照细胞相比,TRPM7沉默显著降低了SKOV3和HO8910细胞的葡萄糖摄取、乳酸产生和ECAR。这些数据表明,TRPM7缺陷抑制卵巢癌细胞的糖酵解,而HIF-1α过表达则消除了这一作用。
接下来,他们测试了AMPK的抑制如何调节卵巢癌细胞中TRPM7沉默促进的OXPHOS。而图5D~G数据显示,TRPM7沉默显著增加了卵巢癌细胞中ATP、ROS的产生以及NAD+/NADPH和OCR的比例,而CC处理显著减轻或消除了这些影响。因此,HIF-1α过表达可显著减轻或消除TRMP7沉默导致的糖酵解降低,AMPK抑制可消除TRPM7沉默增强的卵巢癌细胞OXPHOS。
6. TRPM7沉默增强AMPK激活,降低HIF-1α蛋白水平,将卵巢癌细胞中的糖酵解转化为OXPHOS
接下来,作者探讨了TRPM7沉默如何调节卵巢癌细胞中AMPK的激活、HIF-1α的表达、OXPHOS和糖酵解。图6A显示,二甲双胍激活AMPK明显增加了SKOV3和HO8910细胞中IDH3B和UQCRC1的表达,而HIF-1α沉默可以减轻这种表达。另外,图6B表明,用CC抑制AMPK激活显著降低了IDH3B和UQCRC1的相对表达水平,在HIF-1α沉默的SKOV3和HO8910细胞中进一步降低了IDH3B和UQCRC1的表达水平。
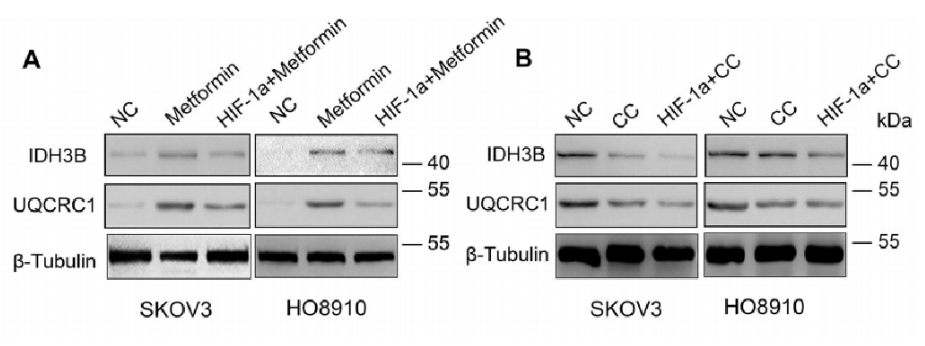
同样,图6C~D显示,TRPM7沉默增加了这些细胞中AMPK磷酸化、IDH3B和UQCRC1的表达,这些表达受到CC的限制;但TRPM7沉默降低了SKOV3和HO8910细胞中HIF-1α、HK2和PDK1的表达,这些细胞通过诱导HIF-1α过表达而获救。总之,TRPM7沉默增强AMPK激活并降低HIF-1α蛋白水平,从而将卵巢癌细胞中的糖酵解转变为OXPHOS。
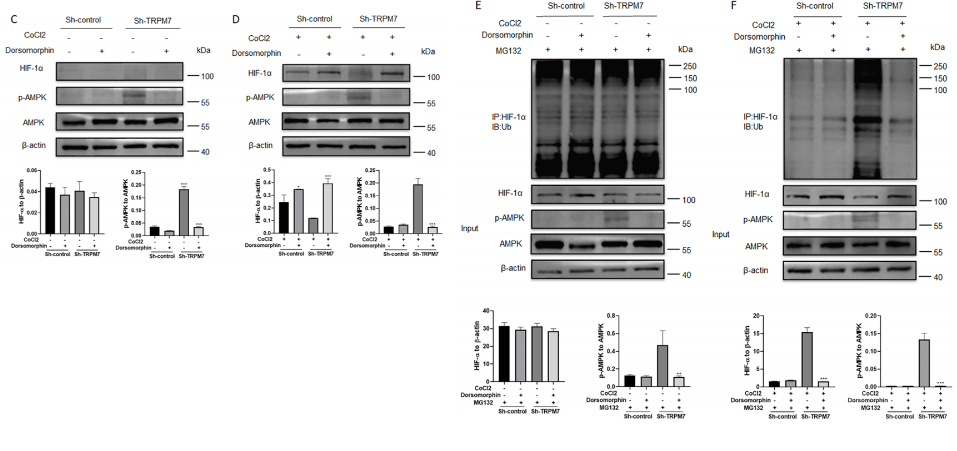
7. TRPM7沉默增强AMPK激活,促进卵巢癌细胞中HIF-1α泛素化和降解
最后,作者研究了TRPM7沉默如何降低卵巢癌细胞中HIF-1α蛋白水平。图7A显示,缺氧诱导卵巢癌细胞中HIF-1α蛋白表达,而在TRPM7沉默的卵巢癌细胞中,HIF-1α蛋白表达非常弱。图7B表明,不管存在缺氧条件和TRPM7沉默与否,蛋白酶体抑制剂MG132都能显著恢复卵巢癌细胞中的HIF-1α蛋白水平,这表明TRPM7沉默促进了HIF-1α的泛素化和蛋白酶体降解。
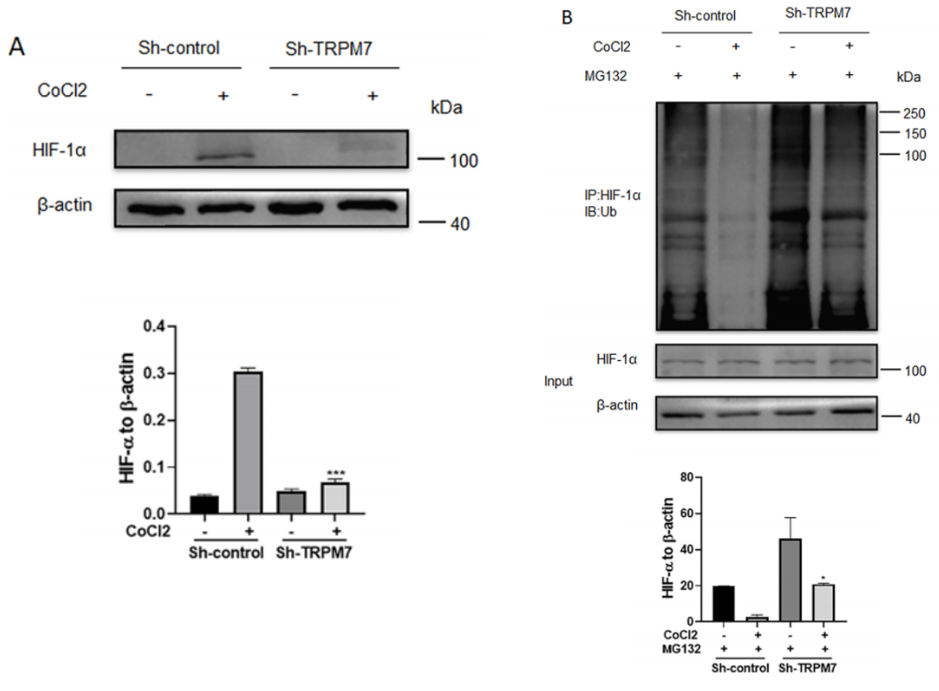
此外,图7C~F显示,用CC抑制AMPK激活的处理恢复了对照组、缺氧和常氧条件下TRPM7沉默卵巢癌细胞中HIF-1α蛋白水平,并降低了其中的泛素化。总之,TRPM7沉默增强AMPK激活,促进HIF-1α的泛素化和蛋白酶体降解,将卵巢癌细胞中的糖酵解转化为OXPHOS。
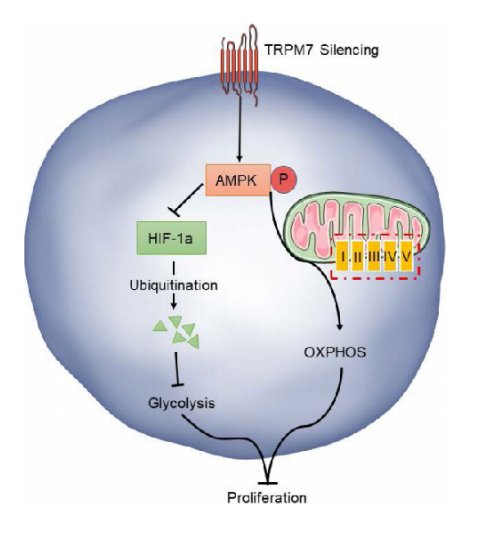
四、具体机制
下图显示了卵巢癌细胞糖代谢重编程的机制。TRPM7沉默通过调节卵巢癌细胞中的AMPK/HIF-1α信号,从而抑制糖酵解,促进OXPHOS。此外,TRPM7沉默可以增强AMPK的激活,促进HIF-1α泛素化蛋白酶体降解(即通过泛素化途径促进HIF-1α降解),减弱HIF-1α对糖酵解的促进作用,将糖酵解转化为OXPHOS,抑制卵巢癌细胞增殖和肿瘤生长。
该发现可能揭示了TRPM7在卵巢癌生长中的新功能,并暗示TRPM7可能成为卵巢癌治疗设计的新靶点。
 文章推荐
文章推荐