2024国自然热点“支原体肺炎”了解一下!宁夏大学这篇肺炎支原体刺激促炎反应的设计思路真的太顶了!
2024-11-25 16:06:38
|
访问量:14572
近两三年来,“新冠肺炎”可以说是一项非常热门的研究课题,但如果大家都一窝蜂地挤在一个“赛道”里,或许科研灵感反而会被堵塞呢?!不如转换一下研究视角,来了解一下“支原体肺炎”的相关研究,或许会有不一样的收获哦~
支原体肺炎(Mp)是由肺炎支原体引起的一种间质性肺炎。基于中国的研究报告,肺炎支原体感染占20~30%,较为常见,那么关于支原体肺炎有什么课题设计思路呢?今天我们一起来探讨一下。
下面,我们将通过这篇发表于International Journal Of Molecular Sciences,名为《肺炎支原体感染巨噬细胞释放的细胞外囊泡通过TLR2-NF-κB/JNK信号通路刺激促炎反应》,影响因子为4.9的文献,来解析支原体肺炎的具体研究思路,希望大家可以从中获得灵感。

【文章题目】:肺炎支原体感染巨噬细胞释放的细胞外囊泡通过TLR2-NF-κB/JNK信号通路刺激促炎反应
【发表期刊】:International Journal Of Molecular Sciences
【影响因子】:IF=4.9
【发表日期】:2023.05
一、研究背景
①宿主巨噬细胞(MΦs)模式识别受体(PRRs)在Mp感染过程中检测病原体相关分子模式(PAMPs)并导致促炎症反应。
②由病原体感染的巨噬细胞衍生的EV携带细菌或病毒成分到受体细胞并诱导细胞反应。
③NF-κB被认为是TLR诱导反应的主要协调者,NF-κB的激活对TLR功能至关重要。
④先前的研究表明,来自克鲁氏锥虫感染的巨噬细胞的EV通过TLR2和NF-κB诱导促炎因子。
⑤然而,尚无关于EV参与肺炎支原体感染免疫应答的报道。
二、技术路线
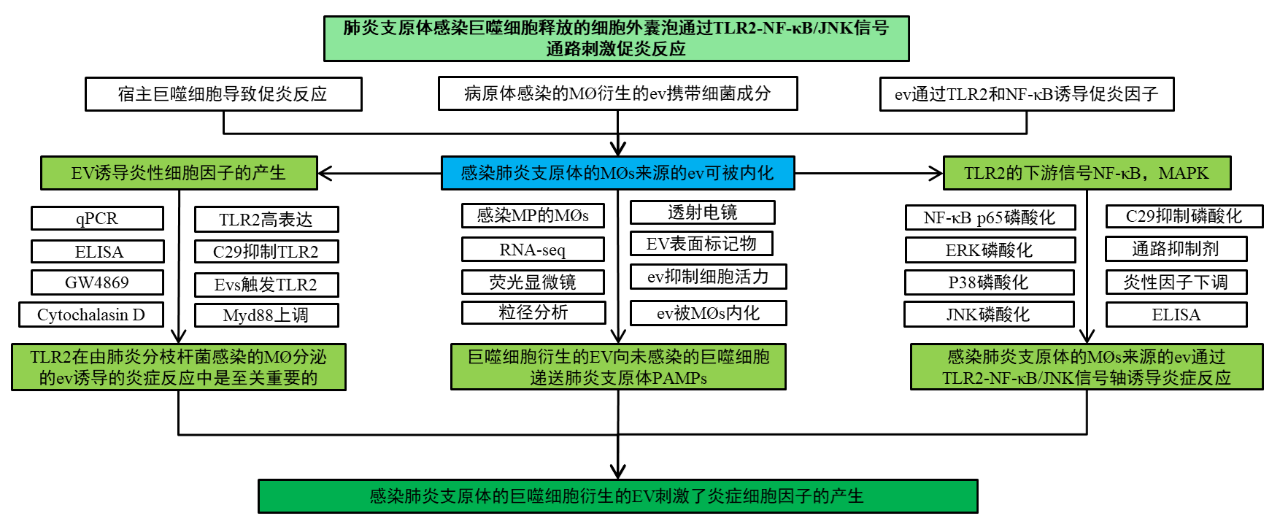
三、研究结果
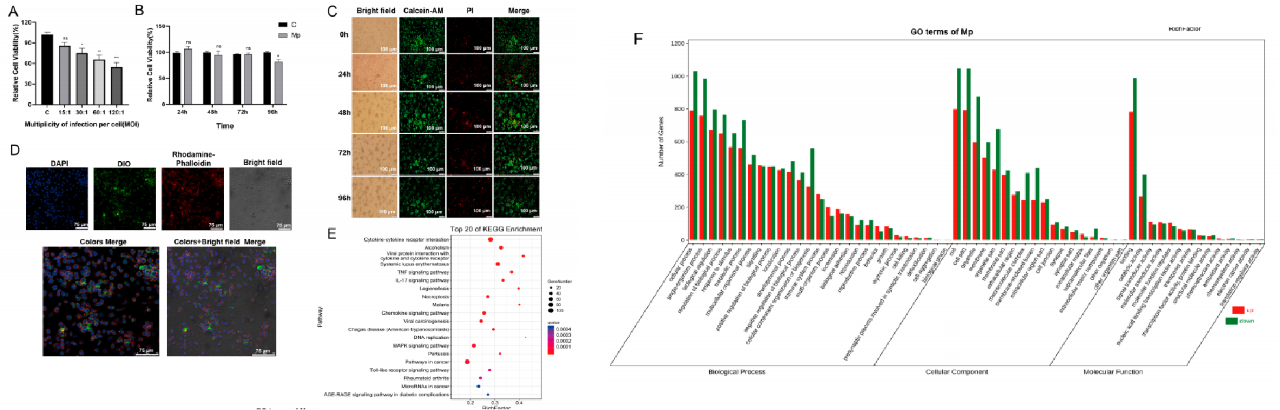
为了研究EV在免疫中的功能,作者首先建立了肺炎支原体感染的MΦs模型,在图1A中发现相对细胞活力随着MOI的增加而降低,MOI为30,MΦs感染Mp在24小时后细胞活力显著降低。此外,图1B显示,MOI为15时,感染的MΦs相对活性在96h后下降。接着作者从荧光显微镜下观察细胞形态,如图1C所示,感染的MΦs随着感染时间的推移而分化。然后又对感染肺炎支原体24h的MΦs进行RNA-seq分析,如图1E~F所示,这些数据表明,该模型可以用于MΦs感染肺炎支原体分泌EV。最终这些结果表明感染肺炎支原体的MΦs模型在巨噬细胞中感染并存活。
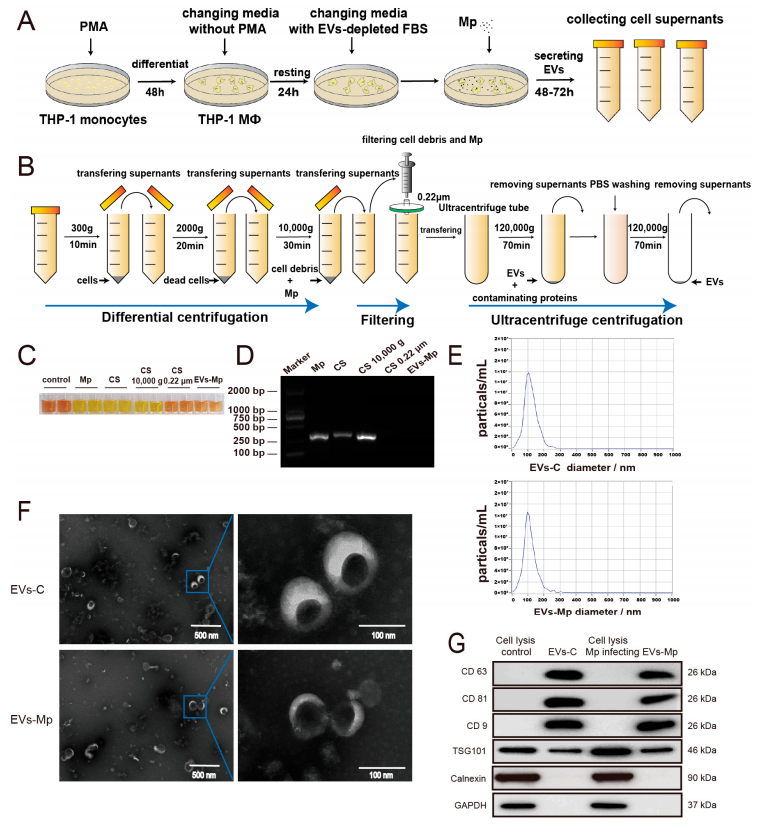
然后作者根据感染细胞模型方法,制备THP-1 MΦs感染肺炎支原体48~72h的细胞上清液,如图2A~D显示,又从感染Mp的MΦs上清液和EV中完全根除Mp,排除了Mp对后续结果的干扰。图2E的纳米颗粒跟踪分析(NTA)显示,从感染Mp的MΦs中分离出的EV与未感染的MΦs中分离出的EV具有相似的直径分布。图2F结果显示,透射电镜观察到直径为100nm的小杯状圆形囊泡结构。图2G的WB分析显示,两种EVs均检测到EVs表面标记物,包括CD63、CD9、CD81和TSG101。这些结果表明,本研究分离的MΦs来源的EV的特征与先前的报道一致。
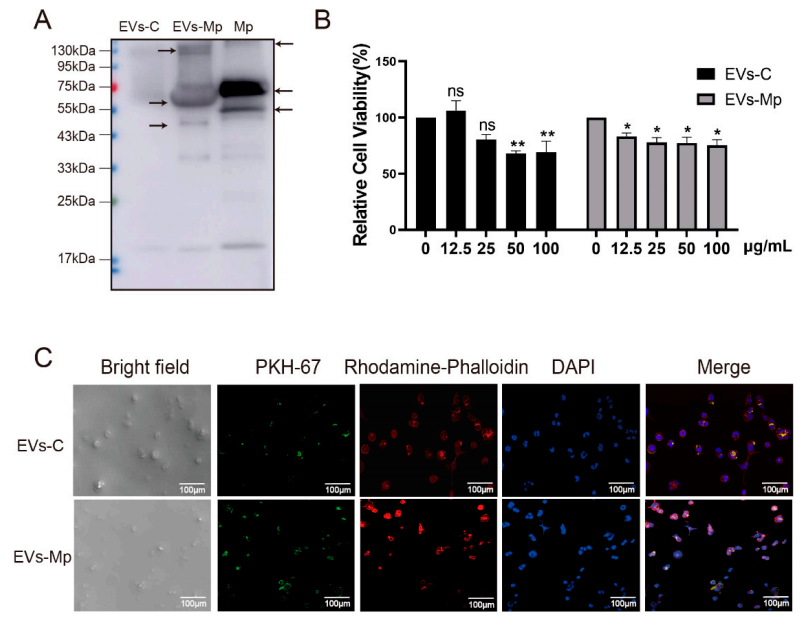
3.巨噬细胞衍生的EV向未感染的巨噬细胞递送肺炎支原体PAMPs接着,作者假设THP-1 MΦs衍生的EV可以将肺炎支原体PAMPs携带到未感染的MΦs。为了验证这一假设,采用Western blot检测EV携带的肺炎支原体PAMPs。我们可以从图3A结果观察到,EVs-Mp有明显的WB反应,表明分泌EVs的感染细胞携带了细菌的抗原成分。然后采用CCK-8法测定细胞活力,如图3B所示,浓度为对照组50µg/mL和感染组12.5µg/mL的EV显著抑制未感染的细胞活力。另外,作者还用PKH67标记MΦs分泌的EV并添加到未感染的MΦs中,然后用共聚焦显微镜观察细胞,如图3C所示,在感染或未感染的MΦs分泌的EV处理的MΦs细胞质中观察到黄色荧光(绿色和红色合并)。这些数据表明,未感染的或受感染的细胞源性EV可能通过暴露于其他MΦs而内化。
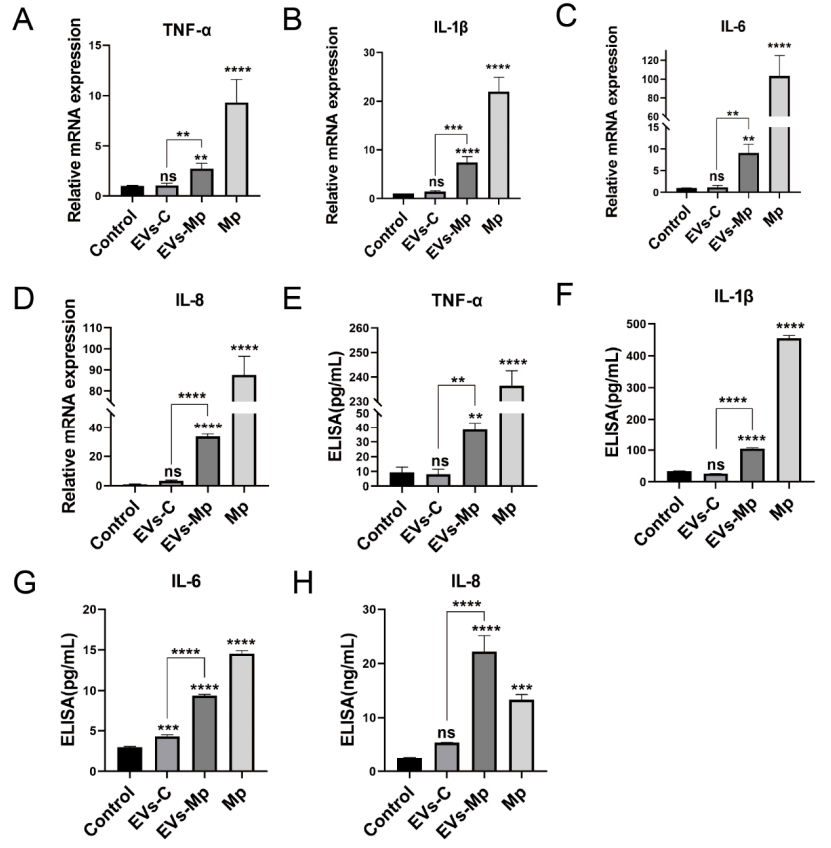
4.肺炎支原体感染巨噬细胞释放的EV诱导炎性细胞因子的产生根据以上研究发现感染的MΦs衍生的EV传递肺炎支原体成分的结果,作者假设这些EV可能具有免疫功能。之后便使用qPCR和ELISA检测EVs,在图4A~H中作者发现,与对照组相比,用肺炎支原体感染的MΦs衍生的EV处理未感染的MΦs时,这些细胞因子的水平显著增加。以上结果表明,感染肺炎支原体的巨噬细胞释放的EV诱导炎症细胞因子的产生。
5.肺炎支原体感染巨噬细胞释放的EV激活toll样受体2 (TLR2)既往研究表明,肺炎支原体可诱导依赖于TLR2、TLR4和TLR6的炎症反应。我们可以从图5A~C观察到,TLR2 mRNA在分别用肺炎支原体感染的MΦs和肺炎支原体感染的MΦs-EV处理的细胞中高表达,然而TLR4的mRNA水平显著降低;在EVs处理中检测到TLR6的类似趋势,但支原体肺炎感染后不显著。所以,作者又采用WB分析了TLR2和TLR4的蛋白表达,如图5D~F所示,TLR2和TLR4蛋白表达的结果与mRNA结果相似。
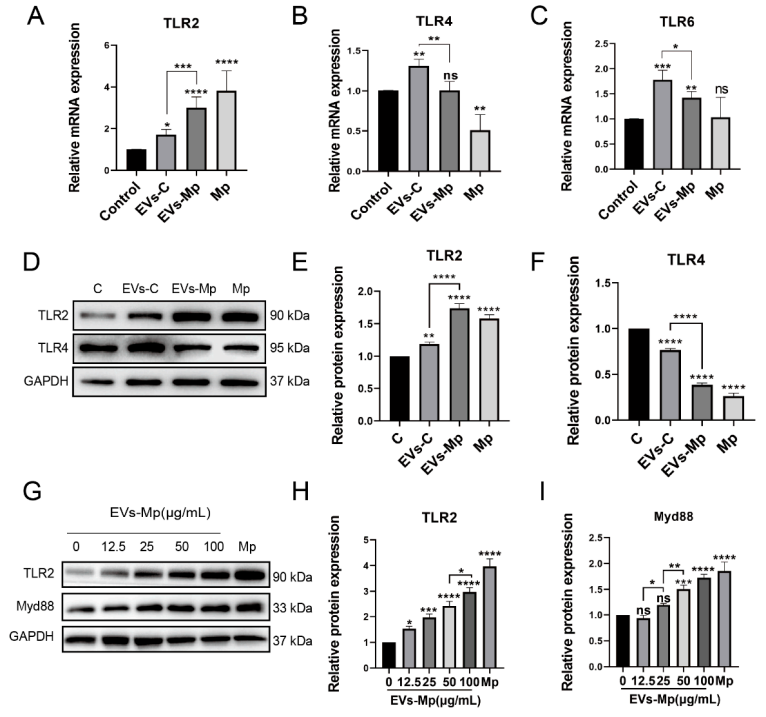
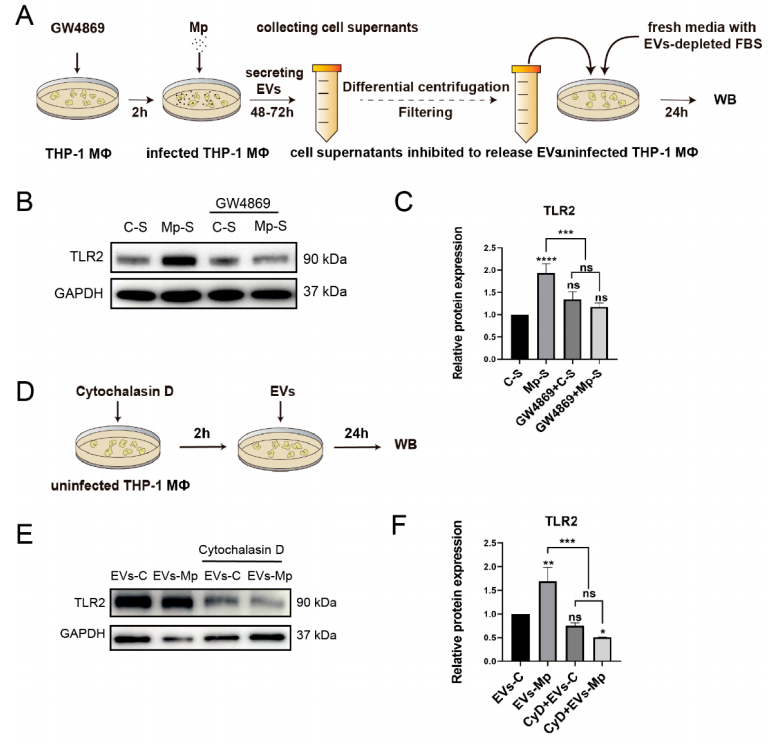
Myd88作为TLR2的下游衔接蛋白,其TIR结构域与TLR2相互作用。我们可以从图5G~I实验结果发现,在EV浓度梯度处理的细胞中检测TLR2和Myd88的表达,进一步证实TLR2信号在EV中的作用,其表达在一定程度上依赖于EV浓度。这些结果表明,来自肺炎支原体感染的MΦs的EV可以激活未感染的MΦs的TLR2通路。6.抑制EV和抑制受体巨噬细胞吞噬可阻断TLR2的激活接着,作者又进一步假设当供体细胞释放的EV被阻断,从而抑制受体细胞摄取时,TLR2不会被激活,并开始了系列验证实验。图6A、6D显示,采用GW4869可阻断EV的分泌,且Cytochalasin D的使用可阻断EV的占用。图6B、6C则显示,在未感染的MΦs与阻断EV细胞上清液共孵育培养和EV竭耗孵育24h的新培养基时,GW4869预处理的感染细胞上清液不能激活TLR2表达。此外,我们还可以从图6E~F观察到,当受体细胞摄取被Cytochalasin D抑制时,TLR2的蛋白表达不会显著上调。这些结果表明,EVs无疑参与了TLR2的触发。
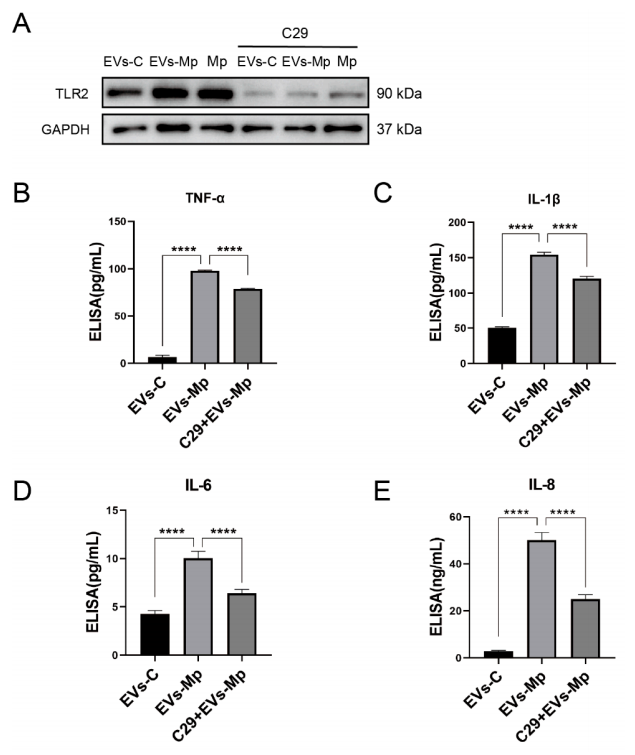
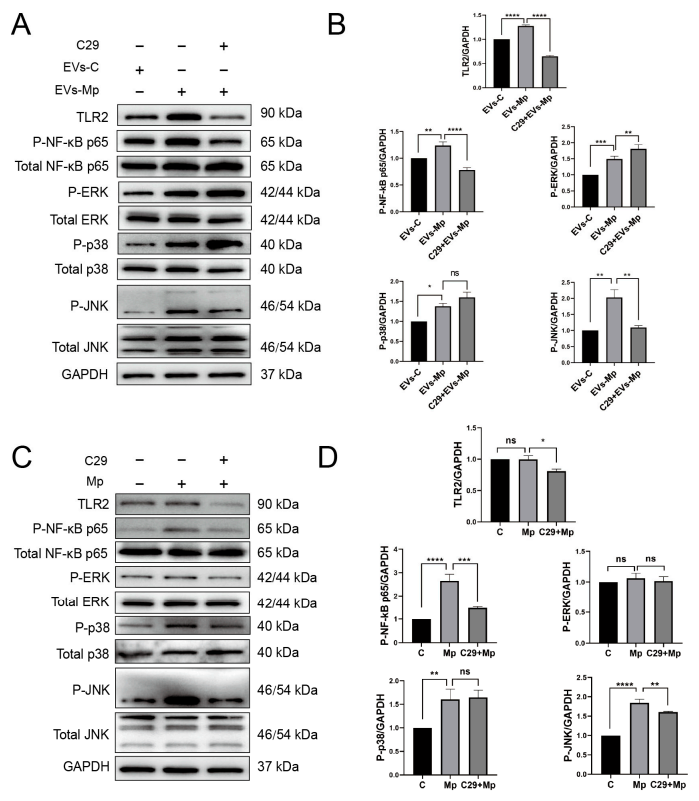
7.肺炎支原体感染巨噬细胞释放的EV诱导的炎症反应依赖于TLR2另外,TLR2抑制剂C29已被证明可抑制人THP-1细胞中的TLR2/1和TLR2/6信号通路。图7A~E显示,当C29抑制TLR2时,感染的MΦs衍生的EV诱导的炎症细胞因子下调,证实TLR2在EVs中激活,诱导炎症细胞因子的产生。这些数据表明,TLR2在由肺炎分枝杆菌感染的MΦs分泌的EV诱导的炎症反应中是至关重要的。
8.来自Mp感染MΦs的EVs通过激活NF-κB和MAPK途径刺激炎症细胞因子的产生为了探究TLR2的下游信号,作者分析了NF-κB p65和MAPK信号重要成分的磷酸化水平。图8A~B显示,由肺炎支原体感染的MΦs衍生的EV在处理120分钟后可诱导NF-κB p65、ERK、p38和JNK的显著磷酸化。然而,从图8B可发现,在处理30分钟后,ERK的磷酸化出现得比其他细胞早。接着,图8C~D结果表明,以Mp直接感染作为阳性对照,各信号成分60分钟后磷酸化。这些结果表明,来自感染肺炎支原体的EV激活了未感染的MΦs中的NF-κB p65和MAPK信号通路,这可能是因为EV携带肺炎支原体的PAMPs。
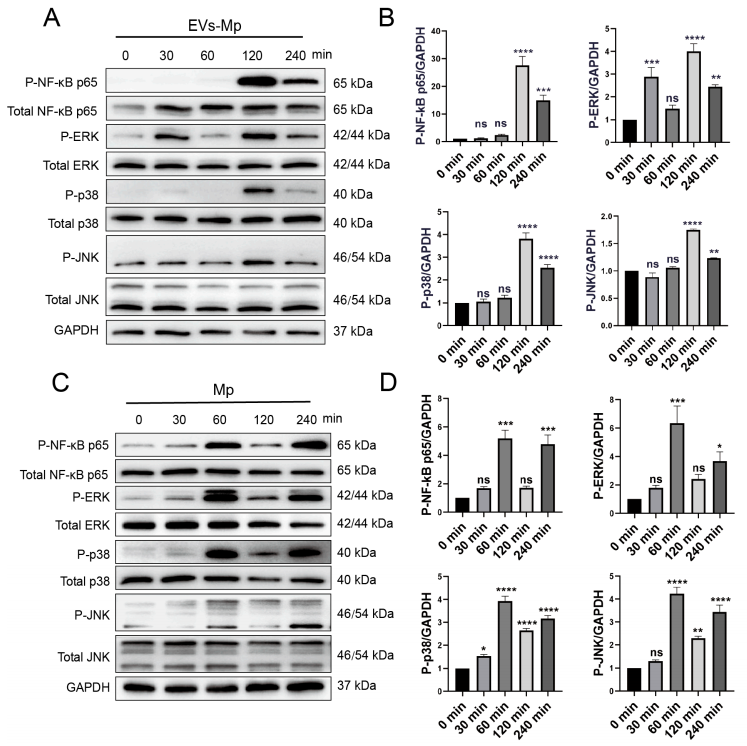
然后,作者用C29处理EV,结果如图9A~B所示,NF-κB和JNK的磷酸化水平显著降低。作为阳性参考,可以从图9C~D中发现,NF-κB p65和JNK的磷酸化水平也被显著抑制。
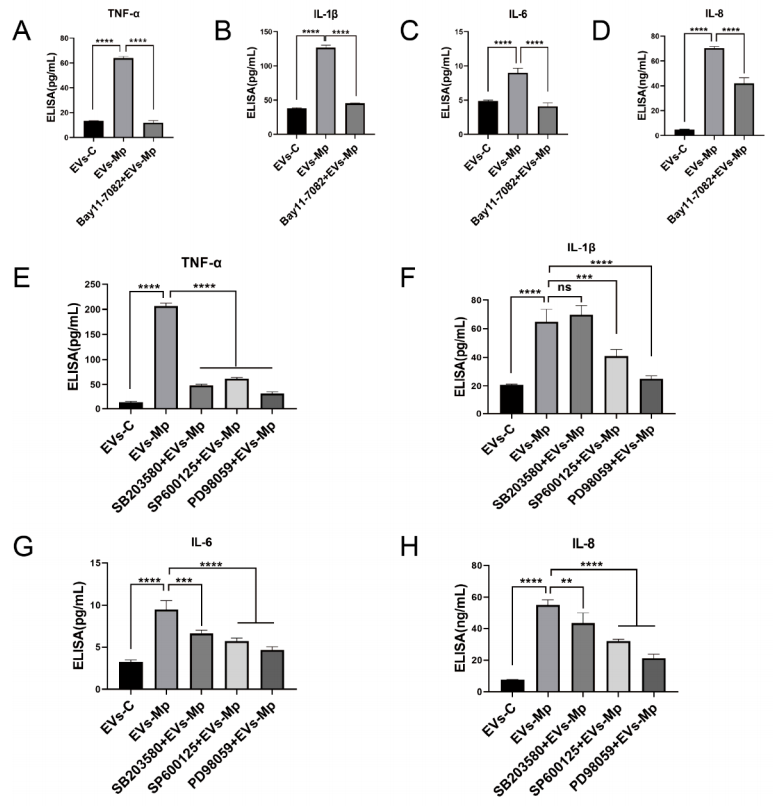
而对于NF-κB和MAPK活性被各自的抑制剂阻断的细胞,作者用来自肺炎支原体感染的MΦs的EV处理未感染的MΦs,图10A~H显示,TNF-α、IL-6、IL-1β和IL-8的产生显著降低;ELISA检测显示,EVs诱导的炎性细胞因子的产生与NF-κB和MAPK信号通路有关。这些发现表明,感染肺炎支原体的MΦs来源的EV通过TLR2-NF-κB/JNK信号轴诱导炎症反应。
四、研究小结
在本研究中,作者首先建立了一个持续分泌EVs的肺炎支原体感染巨噬细胞模型,以进一步评估EVs作为细胞间信使的作用及其功能机制。然后在此模型的基础上,确定了从肺炎支原体感染的巨噬细胞中分离纯EVs的方法,该方法采用了一系列操作,包括差速离心、过滤和超速离心。接着,又采用多种方法鉴定了EVs及其纯度,实验发现受肺炎支原体感染的巨噬细胞中的EVs非常纯净,直径为30~200 nm。这些EVs可被未感染的巨噬细胞吸收,并通过核因子(NF)-κB和丝裂原活化蛋白激酶(MAPK)信号通路诱导肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6和IL-8的产生。此外,还发现EV诱导的炎症细胞因子的表达依赖于TLR2-NF-κB/JNK信号通路。综上所述,这些发现将有助于更好地理解持续性炎症反应和细胞间免疫调节在肺炎支原体感染中的作用。
五、国自然中标情况















 文章推荐
文章推荐