
“铁代谢”和“衰老”可以说是两个永不过时的研究热点,当然也是近几年国自然中标项目中的大热主题!而今天我们要解析的这篇文章就是聚焦于铁积累与纤维化疾病中细胞衰老之间的联系,那么具体有什么样的课题设计思路呢?今天我们一起来探讨一下吧!
下面,我们将分享一篇发表于中科院1区期刊Nature Metabolism,影响因子为18.9的高分文献,名为《铁积累驱动纤维化,衰老和衰老相关的分泌表型》,希望能给大家带来不一样的灵感。

【文章题目】:铁积累驱动纤维化,衰老和衰老相关的分泌表型
【发表期刊】:Nature Metabolism
【影响因子】:IF=18.9
【发表日期】:2023.12
一、研究背景
①中性粒细胞和巨噬细胞引起炎症反应,通过分泌基质金属蛋白酶(MMPs)和纤维化细胞因子促进了进一步的基质重塑。
②纤维形成可由多种外部损伤引起,如毒素和感染。
③衰老细胞的分泌组,即“衰老相关分泌表型(SASP)”是纤维化疾病的主要驱动因素。
④遗传性和获得性血色素沉着症(以组织中铁的积累为特征)极易发展为纤维化疾病。并且,体外衰老细胞中也有铁积累。
二、技术路线
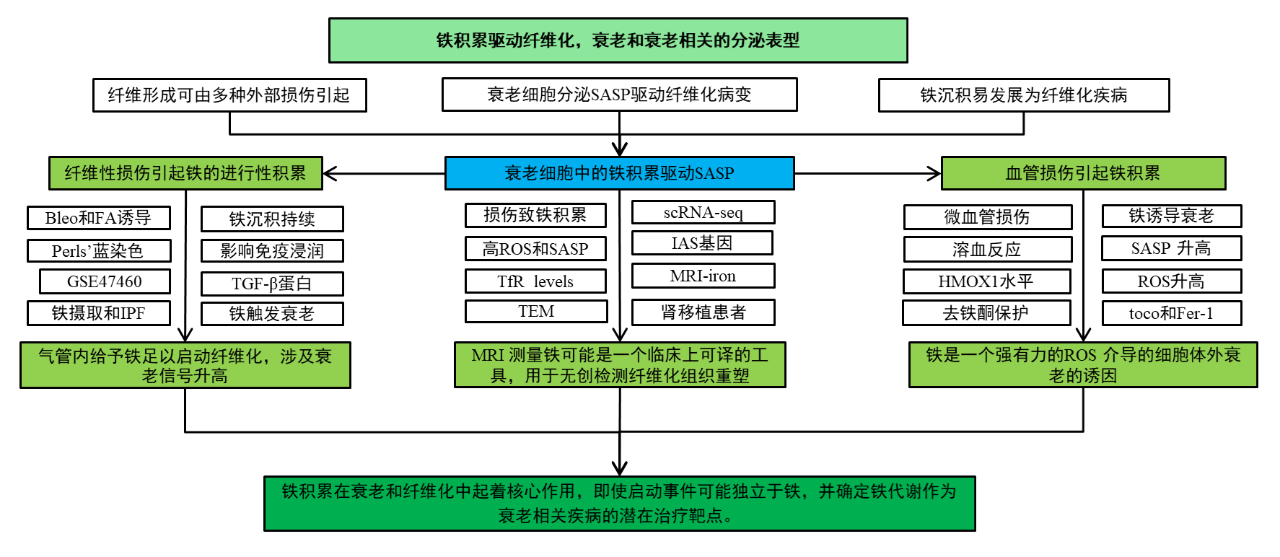
三、研究结果
1.纤维性损伤引起铁的进行性积累
作者首先使用Perl的普鲁士蓝染色以评估铁积累是否是纤维化组织的一般特征,如图1a~b所示,在气管内博来霉素(Bleo)诱导的小鼠肺纤维化和特发性肺纤维化(IPF)患者的肺中观察到铁积累。图1c~d显示,在腹膜内叶酸(FA)注射诱导的小鼠肾纤维化中也有类似结果;在糖尿病肾病(dkD)患者的肾活检中,Perl阳性细胞水平与间质纤维化和IFTA评分直接相关。图1e显示,在公共数据集中,IPF患者的铁转运特征显著增加,这表明铁摄取和储存基因的基因表达改变是IPF的一个决定性特征。
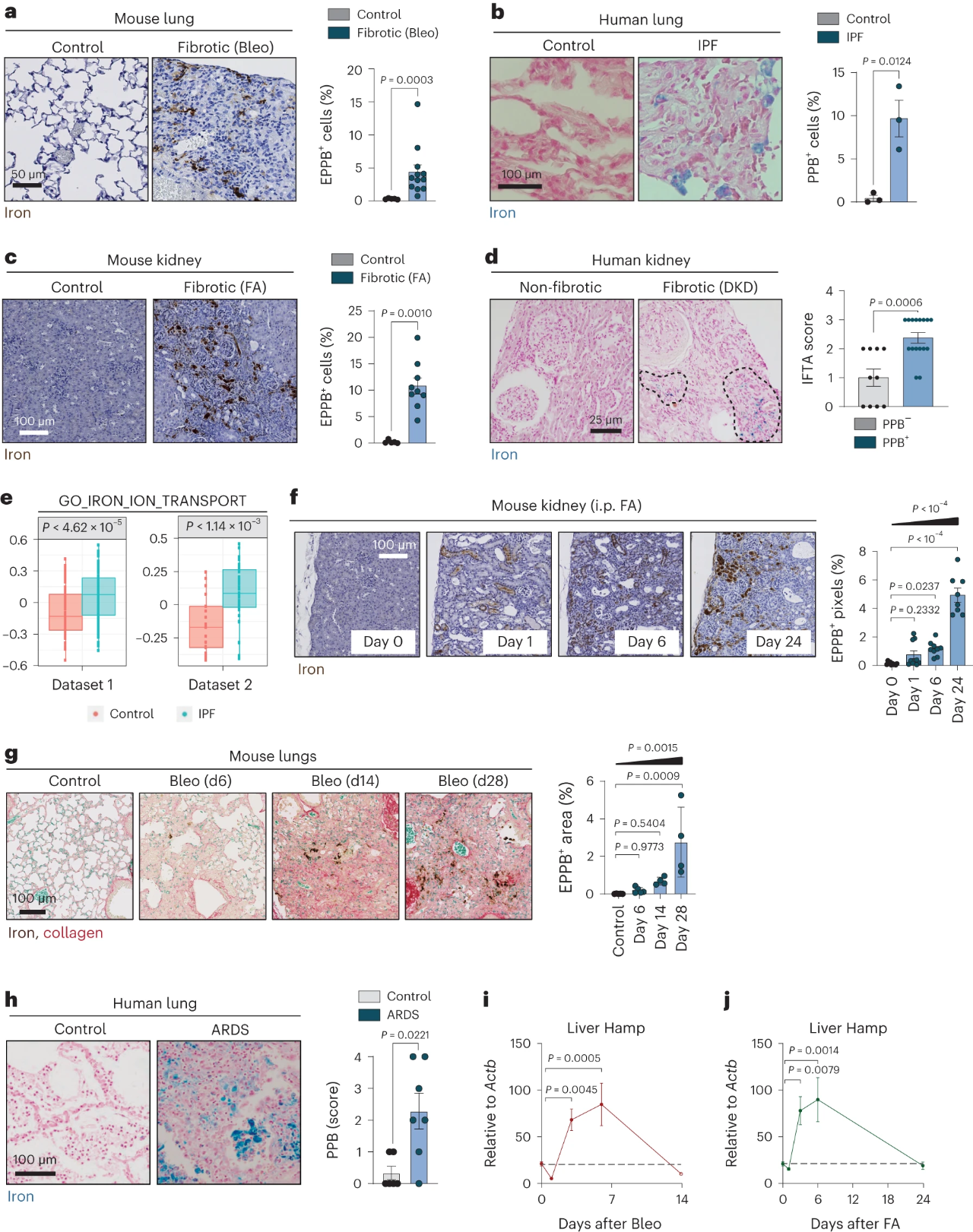
此外,我们可以从图1f~g观察到,在纤维化损伤第一天,FA小鼠的肾脏中就检测到铁沉积,并持续到最后一天;并且在Bleo处理小鼠的肺中,结果类似。图1h~j结果显示,在损伤引发的ARDS患者的肺中多数能观察到铁积累;并且用Bleo或FA处理的小鼠呈现肝铁调素的快速但瞬时的峰值,这表明铁在受损组织中的逐渐积累具有可全身检测的相关性。综上所述,铁的积累可以由损伤引发,并且可以在各种动物模型和人类患者的整个纤维化过程中进展。
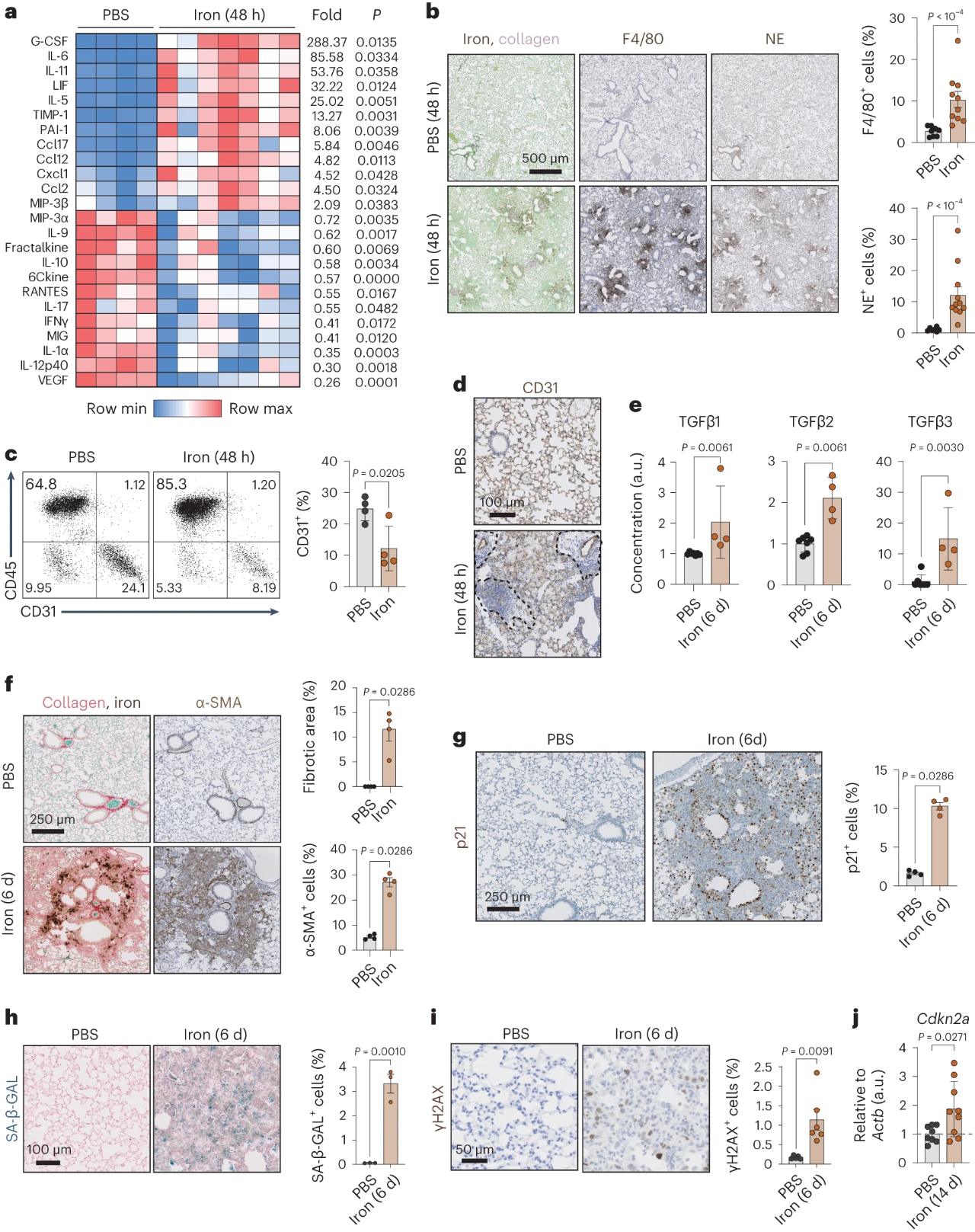
2.铁积累促进纤维形成和衰老
接着,作者想知道铁积累是否是一种旁观者现象,还是在纤维化发生中起致病作用。为此,他们在气管内向小鼠递送游离铁,如图2a所示,损伤后2天内引起强烈的促纤维化细胞因子反应。我们可以从图2b~d观察到富含铁的病灶中有大量巨噬细胞和嗜中性粒细胞涌入;并且铁也诱导CD31+内皮细胞的消耗,这主要影响病灶的免疫浸润。另外,图2e~f显示,在铁输送后6天内,促纤维化TGF-β蛋白就上调了,α-SMA阳性肌成纤维细胞也显著扩增,这与胶原蛋白的强烈积累有关。另外,从图2g~i可以发现,铁触发衰老相关的SA-β-GAL信号、p21+细胞和DNA损伤标志物γH2AX在纤维化病变后6天显著升高。损伤后两周,如图2j所示,用铁处理的小鼠肺中Cdkn2a升高。综上可知,气管内给予铁足以启动纤维化的标志,包括胶原沉积、衰老、血管稀少、炎症和先天性免疫浸润。
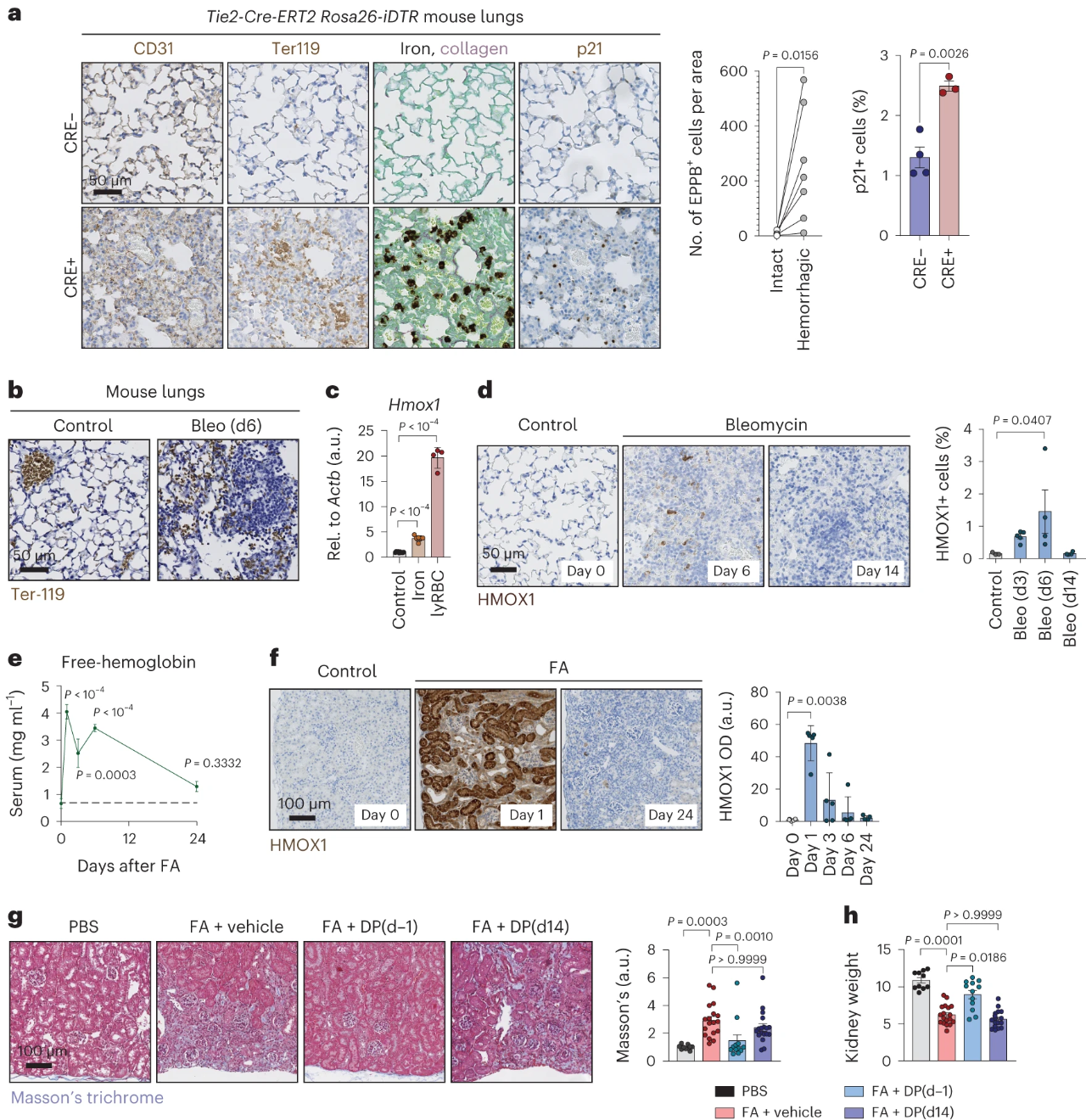
3.血管损伤引起铁积累
考虑到铁诱导纤维化的能力,作者还想知道血管或溶血性损伤是否会导致铁从受损的红细胞中释放出来,从而引起炎症、衰老和纤维化。然后通过实验发现,小鼠模型中微血管损伤的部位可见于CD31染色异常和血管外Ter-119+红细胞的区域,如图3a所示,这些区域含有丰富的铁载体细胞和p21+细胞,图3b显示的是Bleo诱导肺微血管损伤。图3c~d则显示,Hmox1水平在体外对受损的红细胞仍有高度反应,在Bleo注射后第6天达到峰值,并在损伤后第14天达到正常水平。同样,我们还可以从图3e~f结果发现,FA诱导了溶血反应,并在损伤后1天肾脏中Hmox1水平有短暂且大幅的提升。从图3g~h实验结果则发现,在FA诱导小鼠前一天,就给予去铁酮(DP)保护,小鼠肾纤维化和萎缩被缓解,然而DP无法逆转已经建立的纤维化瘢痕。综上可知,血管损伤和溶血性红细胞有能力驱动铁的积累,并可能促进衰老和纤维化。
4.铁和裂解的红细胞在体外引起细胞衰老
为了从机理上深入了解铁与衰老之间的联系,作者又探索了铁对体外培养细胞的影响。我们可以从图4a~b观察到,在所有测试的细胞系中,加入铁、裂解的红细胞或血红素可有效触发衰老;在人黑色素瘤SK-MEL-103细胞中测试,铁诱导的衰老也具有核γH2AX灶的特征。图4c~e显示,在治疗开始后3天,可以观察到铁蛋白亚基以及SASP因子的转录水平增加。图4e显示,在溶解的红细胞的情况下,这些转录效应被DP的存在所消除,表明铁是关键的介质。图4f~h显示,在处理7天后检测到细胞周期阻滞的衰老标志物Cdkn2a和Cdkn1a的上调;铁引起细胞ROS水平的显著升高;ROS清除剂生育酚和Fer-1有效地减轻了溶酶体对铁的反应扩增。从图4i~j结果中可知,在人类黑色素瘤细胞中也是如此。综上,铁的游离形式或从受损红细胞中释放,是一个强有力的ROS介导的细胞体外衰老的诱因。
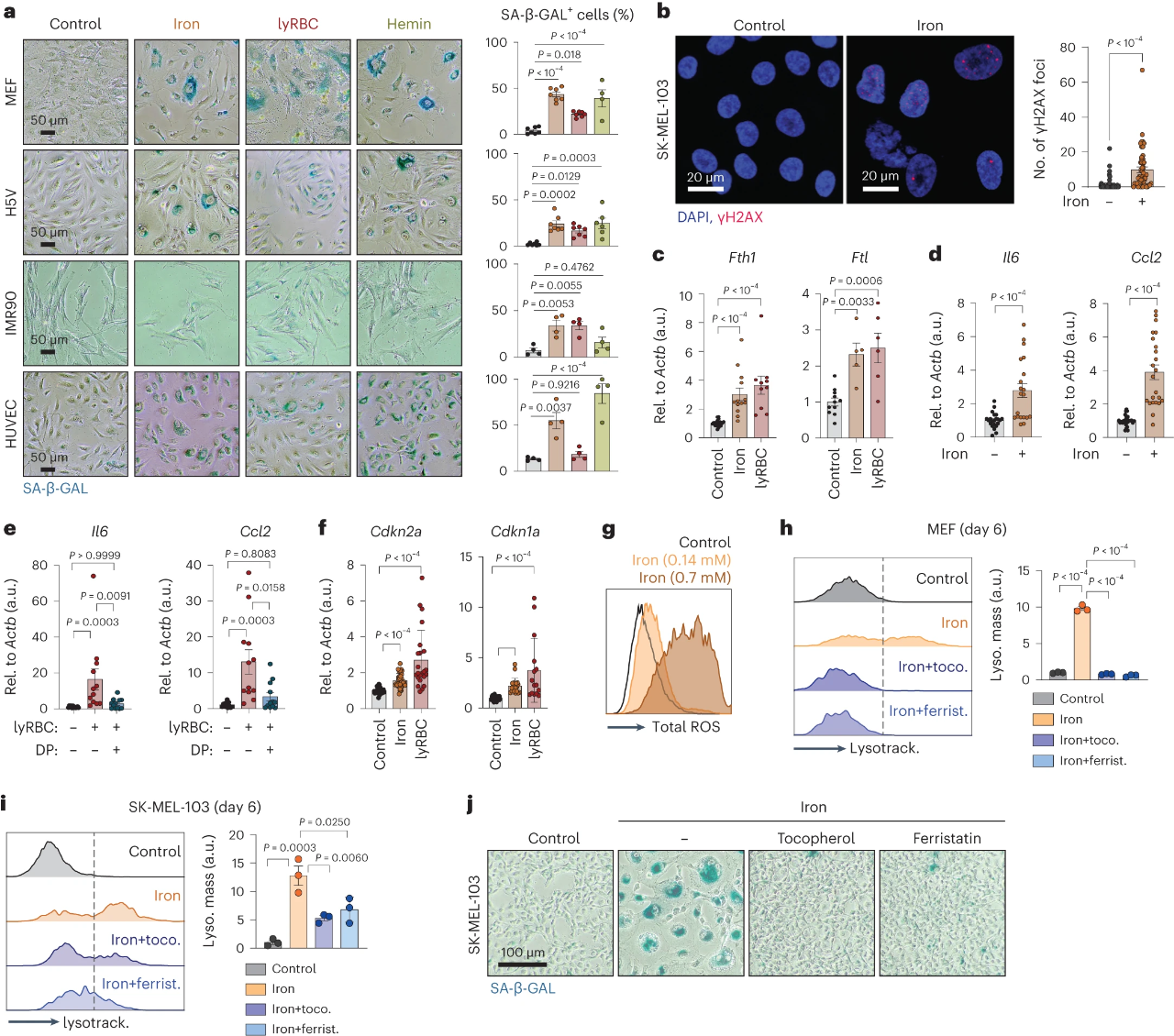
5.衰老细胞中的铁积累驱动SASP
然后,作者开始进一步了解在没有过量铁的情况下,触发的细胞损伤和衰老如何导致铁在体外积累。图5a~b实验结果显示,在损伤后3天,总铁水平就逐渐增加,铁蛋白含量上调。图5c~d则显示,铁蛋白的上调还伴随着人包皮成纤维细胞的复制性衰老。接着,可以从图5e~f观察到衰老细胞表达高水平的转铁蛋白受体(TfR),与增殖细胞相似,而静止细胞(通过血清剥夺或mTOR抑制“休眠”)显著降低了TfR的水平。图5g~h显示,通过使用增强的普鲁士蓝染色,发现了铁沉积物集中在衰老细胞的细胞质斑点中。另外,图5i~j的透射电子显微镜图像显示,这些斑点对应于含有大量铁蛋白结合铁的溶酶体。在图5k~l中,他们发现除了增加铁蛋白结合铁,还发现衰老细胞中不稳定铁库显著升高。当用DP处理完全衰老的细胞30分钟时,如图5m所示,ROS水平显著降低。从图5n则观察到,有13种细胞因子和趋化因子在衰老时显著升高,而用DP的无毒剂量处理衰老细胞3天,13个中的10个被显著抑制。综上可知,即使在正常铁条件下触发细胞损伤,也会导致铁累积,从而导致衰老细胞特有的高水平ROS和SASP。

6.肺纤维化中铁积累的单细胞动力学
研究发现,被损伤诱导的铁释放和损伤诱导的铁积累可能具有不同的动力学。为了更深入了解这两个阶段对铁反应的细胞类型,在铁暴露后2天和6天对小鼠肺进行了单细胞RNA测序。图6a~b结果显示,铁剂的使用引起了肺部的显著变化。铁引起嗜中性粒细胞的短暂募集,单核细胞,还有杯状细胞和成纤维细胞群2的相对丰度显著瞬时增加,其与其他成纤维细胞1分开聚集。图6c~d显示,参与细胞内铁稳态的基因表现出细胞类型依赖性变化。另外,还可以从图6e~f发现,铁积累是成纤维细胞2细胞扩增的驱动因素。值得注意的是,图6g~l表明,铁累积特征IAS基因和衰老标志物的细胞双阳性在IPF患者中十分显著。综上可知,衰老细胞可能是纤维化组织中铁积累的重要贡献者。
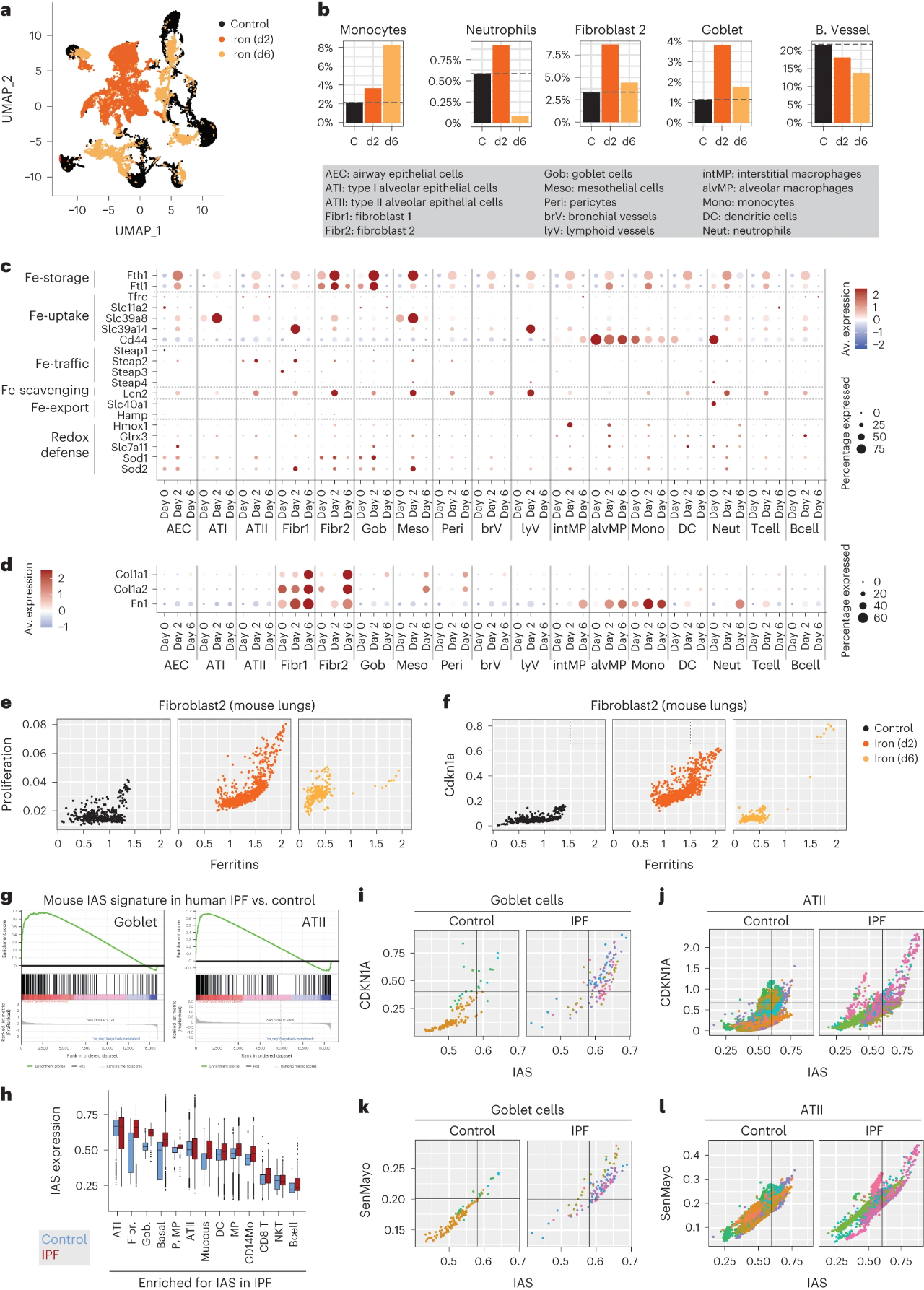
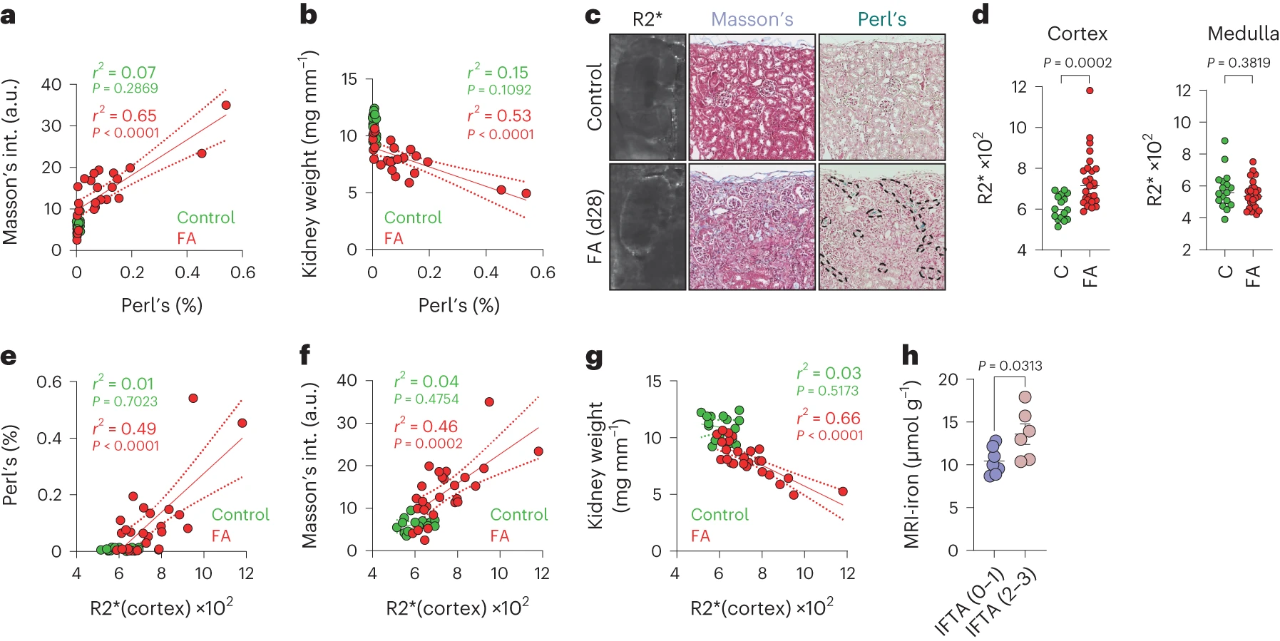
7.MRI检测铁作为肾纤维化的生物标志物
最后,作者想进一步探究检测纤维化组织中的铁积累是否可以作为无创医学成像检测纤维化的替代方案。我们可以从图7a~b结果发现,在FA小鼠中Perl阳性细胞与Masson染色正相关,而与肾重量呈负相关。然后,利用磁共振成像技术(MRI)可以检测到铁离子,如图7c~g所示,肾脏的皮层中有显著升高的信号。招募肾移植患者发现,如图7h所示,IFTA评分高的患者(2分和3分)比IFTA评分低的患者(0分和1分)皮层R2信号明显高。综上可知,MRI测量铁可能是一个临床上可译的工具,用于无创检测纤维化组织重塑。
四、研究小结
研究表明血管和溶血性损伤可以有效地触发铁积累,而铁积累反过来会导致衰老并促进纤维化。此外,研究还发现衰老细胞会持续积累铁,即使细胞外铁的激增已经减弱。事实上,在细胞外铁的正常条件下,暴露于不同类型的衰老诱导损伤的细胞会积累大量的铁蛋白结合铁,主要在溶酶体内,并呈现高水平的不稳定铁,这促进了活性氧和SASP的产生。接着证明了通过磁共振成像检测铁可能允许对小鼠肾脏和肾纤维化患者的纤维化负荷进行非侵入性评估。最终研究结果表明,铁的积累在衰老和纤维化中起着核心作用,即使起始事件可能与铁无关,并将铁代谢确定为衰老相关疾病的潜在治疗靶点。
五、国自然中标情况

 文章推荐
文章推荐