
炎症是生物学的重要组成部分。它可以为机体提供保护,并维持组织和器官功能与结构的完整性,使其免受环境不利因素影响。那么关于细胞炎症有什么课题设计思路呢?今天我们一起来探讨一下。
接下来我们将分享一篇发表于中科院1区期刊Nature Communications,影响因子为14.7的文献,希望能给大家带来不一样的灵感。
一、文章信息

二、研究背景
①巨噬细胞是存在于多个器官的主要先天免疫细胞,在多种疾病中具有功能可塑性,可协调炎症;
②转化生长因子β活化激酶(TAK1)在巨噬细胞中作为促进炎症的关键激酶,被TRAF6泛素化后,引起自磷酸化并激活IKK,最终激活转录因子NF-κb;
③代谢激酶不仅能够调节能量产生、分解代谢和合成代谢过程,还作为信号分子调节多种蛋白质底物和包括炎症在内的关键细胞过程;
④tp53诱导糖酵解和凋亡调节因子(TIGAR)是p53的下游靶基因,与fbpase-2,6具有相似的结构。它能抑制糖酵解并增加细胞NADPH水平以激活戊糖磷酸途径。
三、技术路线
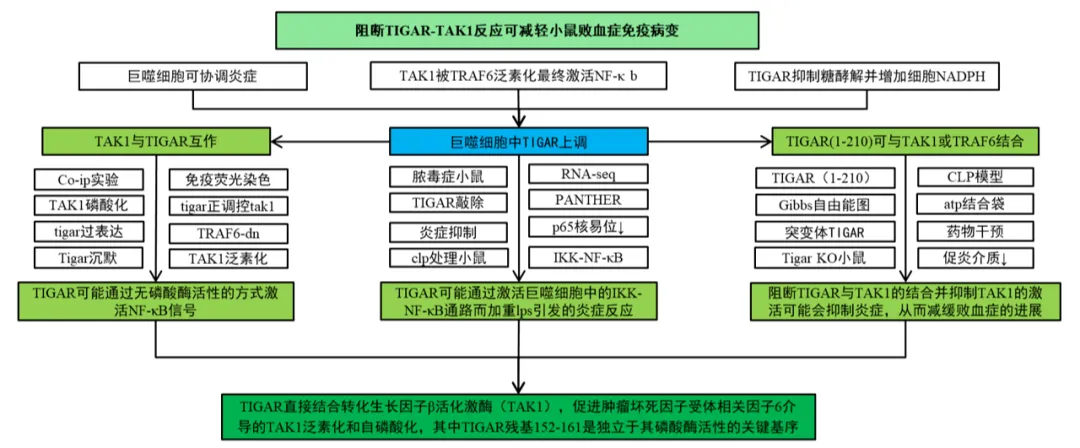
四、研究结果
1.巨噬细胞TIGAR加重小鼠败血症
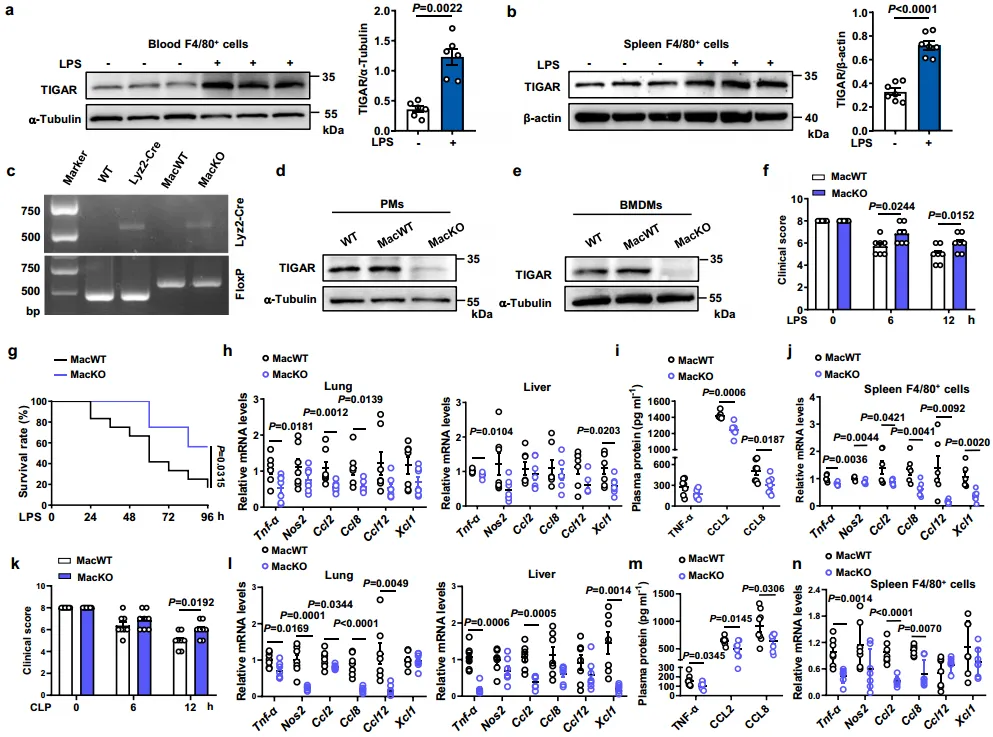
现有研究表明,巨噬细胞在多种疾病中可以协调炎症,为了探究巨噬细胞在败血症中的作用,作者进行了相关研究,结果如图1a~b显示,从脓毒症小鼠血液和脾脏分离的F4/80+细胞中,发现TIGAR的表达均显著上调。随后特异性TIGAR敲除小鼠被脂多糖(LPS)处理后,如图1c~g,MacKO小鼠的活力和存活率显著提高。与此一致的是,MacKO小鼠肺、肝脏和血浆中重要促炎介质的水平也降低了,此外,图1h~i反映了TIGAR髓系缺乏对LPS诱导的急性炎症的抑制作用。值得注意的是,从图1j中得到,TIGAR髓系消融抑制了脾脏F4/80+细胞中促炎基因的表达。图1k~n也表明了在雄性盲肠结扎和穿刺(CLP)处理的MacKO小鼠中观察到一致的表型变化。这些结果表明巨噬细胞TIGAR在小鼠脓毒症中的有害作用,这可能与凝血系统无关。
2.TIGAR促进巨噬细胞炎症反应
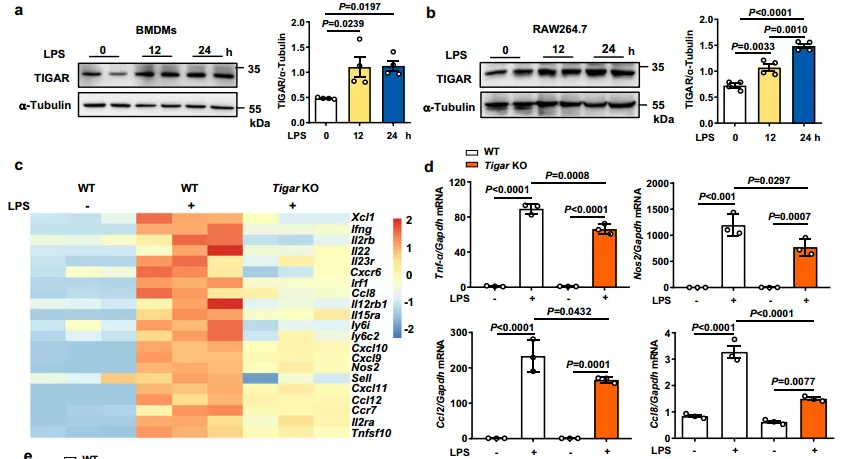
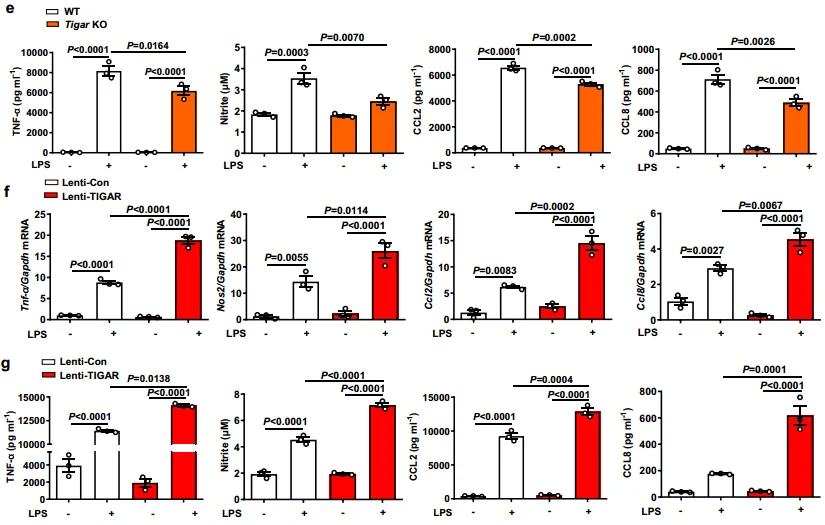
为了进一步探究,TIGAR在巨噬细胞炎症中的作用,他们进行了相关实验,从图2a~b中,可以看到LPS处理诱导过的骨髓源性巨噬细胞或RAW264.7细胞中TIGAR上调。mRNA测序(RNA-seq)显示,在LPS处理的bmdm中,TIGAR消融导致131个基因下调。并且这131个下调基因与细胞对细胞因子和免疫相关过程的反应密切相关。图2d~e中显示,TIGAR缺乏导致LPS处理或TNF-α处理的TIGAR KO BMDMs中促炎介质的产生减少。相反,TIGAR的过表达刺激了LPS诱导的巨噬细胞中炎症介质的过度产生,如图2f~g所示。这些数据表明,TIGAR促进了巨噬细胞中的促炎反应。
3.TIGAR通过激活巨噬细胞中的IKK-NF-κB信号来刺激炎症
随后,研究员通过PANTHER富集分析发现在败血症中,TIGAR缺乏影响NF-κB信号介导的炎症反应。从图3a~c得到,TIGAR消融抑制了LPS处理的BMDMs中IKK和p65的磷酸化、i-κbα降解和p65的核易位。如图3d~f所示,TIGAR在培养的RAW264.7细胞中过表达显著激活IKK-NF-κB信号,促进炎症反应。通过使用特异性nf-κB通路抑制剂Bay11-7082,进一步确定了TIGAR对IKK-NF-κB通路的激活作用。综上所述,TIGAR可能通过激活巨噬细胞中的IKK-NF-κB信号通路而加重LPS引发的炎症反应。
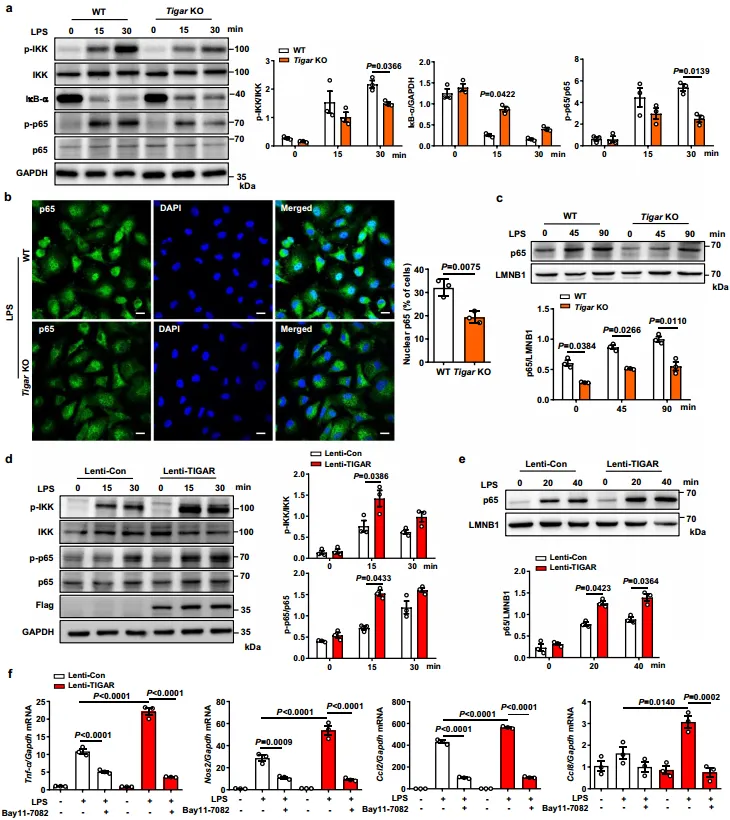
4.TIGAR通过促进巨噬细胞信号转导TAK1磷酸化激活NF-κB信号通路
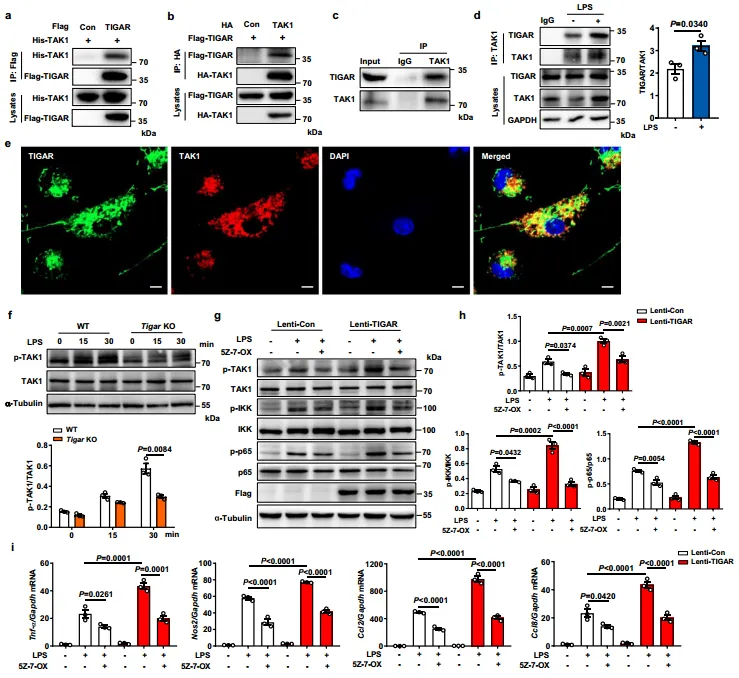
5.TIGAR通过诱导TRAF6和TAK1之间的相互作用促进TAK1泛素化
泛素化对于TAK1随后的自磷酸化和激活至关重要,从图5a~b可得,在bmdm以及转染的HEK293细胞中,TIGAR正调控TAK1。如图5c~d得知,TIGAR过表达优先增加了K63位点的TAK1Ub偶联物,而不是K48位点。研究员还发现TIGAR过表达促进TAK1与TRAF6的相互作用。相反,如图5f~g显示,TIGAR缺乏抑制了LPS诱导的TAK1与TRAF6之间的相互作用。图5h结果证实,TRAF6的显性阴性突变体(TRAF6~dn)不仅阻断TAK1的泛素化,而且抑制TIGAR增强的TAK1泛素化,表明TRAF6在TIGAR触发的TAK1泛素化中起着桥梁作用。图5i~j的Co-IP分析结果表明,TIGAR、TAK1和TRAF6相互作用,可能形成三聚体。因此,TIGAR可能通过无磷酸酶活性的方式激活NF-κB信号。
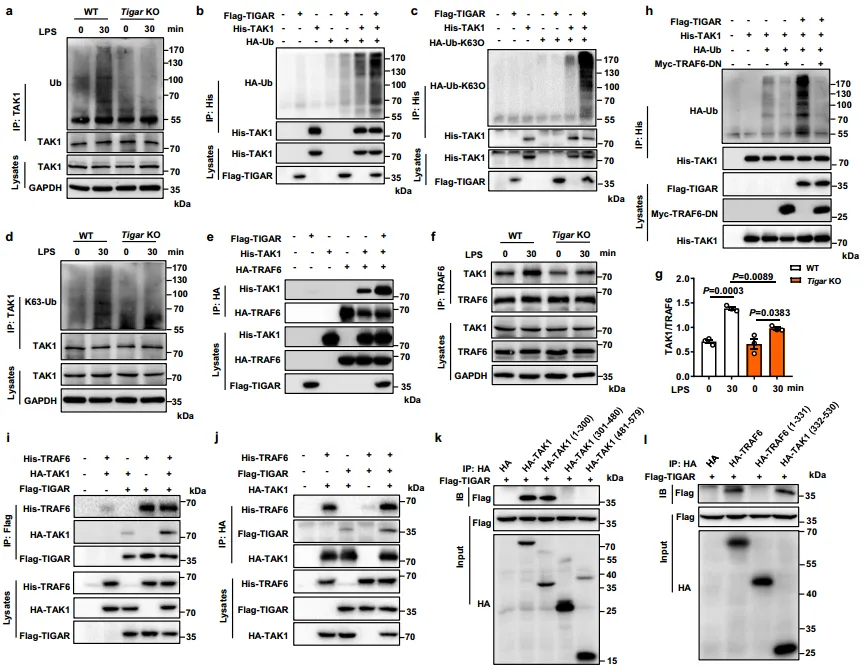
6.TIGAR的残基152-161对TAK1的激活至关重要
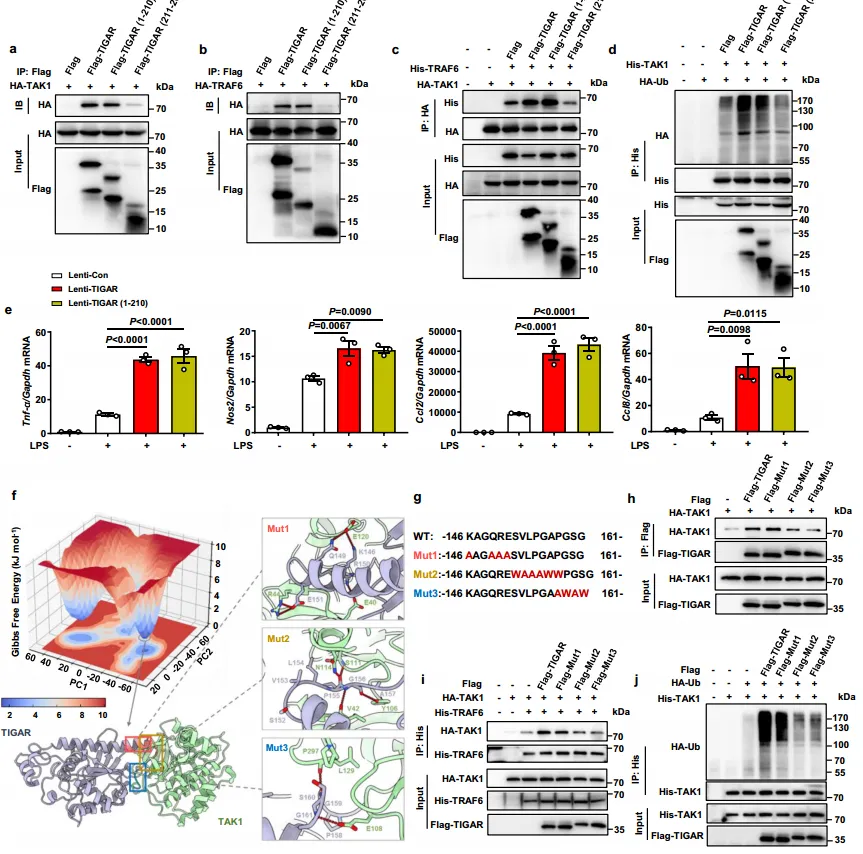
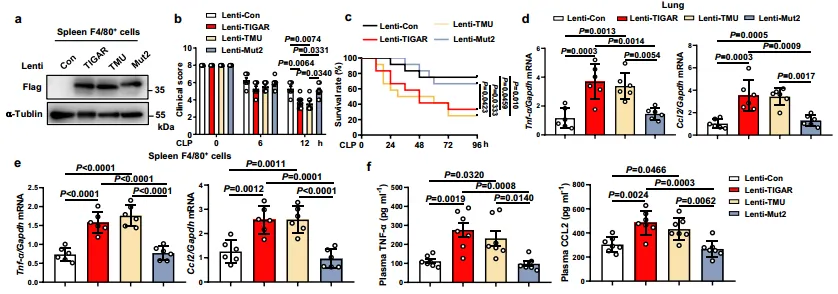
为了进一步了解TIGAR在体内激活TAK1的机制,这里构建了骨髓特异性CD11b启动子驱动的慢病毒,分别编码Flag-TIGAR、Flag-TMU和Flag-Mut2。TIGAR KO小鼠慢病毒感染4天后,生成CLP脓毒症模型。WB结果如图7a显示,转染后的flag-tigar分别在脾脏F4/80+巨噬细胞中表达。图7b~f结果显示,TIGAR或TMU而非Mut2的表达损害了TIGAR KO小鼠的健康状况,降低了生存率,并促进了炎症细胞因子的产生。这些数据清楚地证明了TIGAR结构,而不是其磷酸酶活性,对促进巨噬细胞炎症的必要性。
7.药物抑制TIGAR结合TAK1拮抗小鼠脓毒症
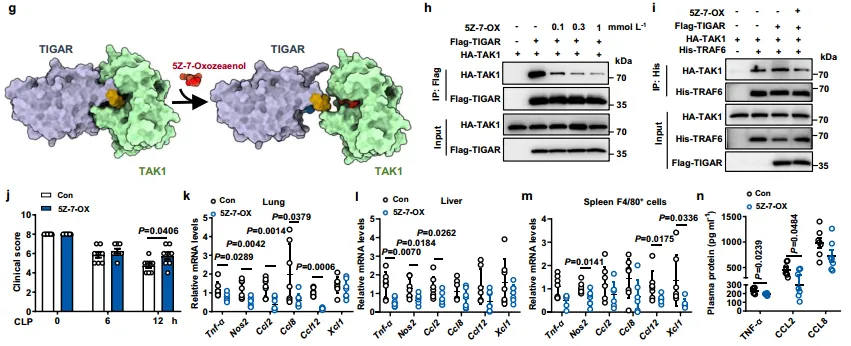
综上所述,TIGAR直接结合转化生长因子β活化激酶(TAK1),促进肿瘤坏死因子受体相关因子6介导的TAK1泛素化和自磷酸化,其中TIGAR残基152-161是独立于其磷酸酶活性的关键基序。5Z-7-oxozeaenol干扰TIGAR与TAK1的结合在雄性小鼠脓毒症模型中显示出治疗效果。
五、研究小结
本研究通过构建小鼠脓毒症模型,发现模型中巨噬细胞的凋亡调节因子(TIGAR)表达上调。当巨噬细胞TIGAR被消除时,无论是通过脂多糖还是结肠结扎穿刺处理的雄性小鼠脓毒症通过炎症抑制而减轻。机制研究表明,TIGAR直接与转化生长因子β激活激酶(TAK1)结合,促进肿瘤坏死因子受体相关因子6介导的TAK1泛素化和自磷酸化,其中TIGAR的152-161残基构成独立于其磷酸酶活性的关键基序。通过5Z-7-氧杂莰醇干扰TIGAR与TAK1的结合在雄性小鼠脓毒症模型中显示出治疗效果。这些发现揭示了巨噬细胞TIGAR在促进炎症方面的非传统功能,并为通过破坏TIGAR-TAK1相互作用治疗脓毒症提供了潜在的治疗靶点。
六、国自然中标情况

 文章推荐
文章推荐