
01
迁移率变动分析
本方案可分4个阶段:
①制备含特异蛋白质结合位点的放射性标记DNA探针;
②制备非变性凝胶;
③结合反应:蛋白质混合物与DNA探针结合;
④蛋白质-DNA复合物凝胶电泳、干胶及放射自显影(图12.2.1)。

典型DNA结合迁移率变动实验的放射自显影示意图
说明:放射标记的探针和poly (dI-dC) ·poly (dI-dC) 与不同量的蛋白质共育,在低离子强度的聚丙烯酰胺凝胶自上而下电泳。图中标示了游离探针和结合蛋白质复合物的位置。泳道1: DNA探针+poly (d-dC) ·poly (d-dC);泳道2~5: DNA探针+poly (dI-dC) ·poly (dI-dC) +递增量的蛋白质粗提物;泳道6:与泳道5相同,但加入过量的poly (dI-dC) ·poly (dI-dC); 泳道7:标准的结合反应;泳道8:标准的结合反应+50倍摩尔过量的未标记DNA探针(特异竞争剂);泳道9:标准的结合反应+50倍摩尔过量的未标记与探针序列无关的DNA (非特异竞争剂)。
材料
10x电泳缓冲液,如TAE或TBE电泳缓冲液或Tris甘氨酸电泳缓冲液
30% (m/V) 过硫酸铵,新鲜配制
TEMED (四甲基乙二胺)
非变性凝胶混合物
多聚物(Bulk) 载体DNA,如poly (dI-dC) . poly (dI-dC)
BSA
含DNA结合蛋白的蛋白质制备物(粗提物或纯化物)
10x带染料的加样缓冲液
恒温水浴
双头蠕动泵
10μl玻璃毛细吸管(选用)
Clay- Adams螺口头加样器(选用)
Whatman 3MM滤纸或相当的滤纸
步骤
用作探针的DNA片段长度为20~300 bp。DNA片段越长,含有多个蛋白质结合位点的可能就越高,对凝胶电泳结果的分析就越困难。DNA探针可以用几种方法中的一种来制备。
1a)对于限制性内切核酸酶切片段:用标准的限制酶消化方案。从质粒上切下含靶结合位点的DNA小片段。DNA片段用大肠杆菌Klenow酶和32 P标记核苷酸或多核苷酸激酶进行末端标记,在凝胶电泳中分离回收片段。在使用蛋白质粗制备物的实验中,因其中可能含有磷酸化酶活性,避免使用多核苷酸激酶末端标记的探针。
1b)对于合成寡核苷酸:合成互补的寡核苷酸,通过复性产生含靶结合位点的双链DNA片段。探针用多核苷酸激酶进行末端标记。
1c)对于PCR片段:通过聚合酶链反应产生含靶位点的DNA片段。以多核苷酸激酶在PCR反应前末端标记引物或在纯化后标记PCR双链产物。
2)分离探针,用溴化乙锭斑点定量法确定其浓度。
3)取1 μl在闪烁计数仪中进行契仑科夫计数测定其放射比活(cpm/μl)。典型的结合反应需含约5000~20 000 cpm和约10~100 fmol探针(10 μl反应总体积中含10 fmol DNA,其DNA浓度为1 nmol/L)。如果需要的话,在继续实验前探针在4℃可存放4~6周。
4)稀释10x电泳缓冲液至1x,其量应足够灌满电泳槽。
5)用清洗干净的玻璃板和1.5 mm间隔片组装凝胶夹层,准备灌胶。去污剂会干扰蛋白质-DNA的相互作用。
6)在用同样电泳缓冲液配制的60ml非变性凝胶混合液中加150μl 30%的过硫酸铵及70 μl TDMED,轻轻摇匀。
7)将凝胶混合液灌人玻璃板之间,插人齿宽≥7 mm的梳子,让胶聚合20 min。
8)将梳子和底边的垫片取出。下储液槽加入1x电泳缓冲液后,将胶放人电泳槽中。上储液槽也加入1x缓冲液。用带弯针的注射器排去胶下面的气泡并冲洗加样孔。100 V预电泳30~60 min。对于低离子强度的缓冲液(≤0. 5x),用泵的两端以每分钟30 ml的流速在上下槽之间交换缓冲液。缓冲液的再循环可以防止因缓冲液的低缓冲容量产生的极化。
9)预电泳时,在0.5 ml或1.5 ml微量离心管中混合如下成分(最后加蛋白质):5000~20 0000 cpm放射标记探针DNA (0. 1~0.5 ng,≥10 fmol) 300 μg/ml BSA≥10% (V/V) 甘油。适当的缓冲液和盐DNA结合蛋白质(约15μg粗提物或约5~ 25 ng纯化的蛋白质)反应总体积用水或缓冲液调至10~ 15μl。
10)用手指轻拍打管底以混匀反应物。
11)恒温水浴温育结合反应约15~30 min。最适反应温度因蛋白质而异,室温至37℃。
12)用10μl玻璃毛细管或Clay-Adams加样器或加样枪将各结合反应物加入到预电泳的凝胶样品孔中。另外在一个孔中加人小体积的10x样品缓冲液。由于本系统没有积层胶,需要精确加样,尽量减少和电泳缓冲液混合,以获得清晰的分离条带。
13)在30~35mA下电泳,只需很少的电泳时间应足以使蛋白质DNA结合物和游离探针得到很好的分离。当溴化乙锭到达凝胶底部时停止电泳(15~20 cm胶需1.5~2 h)。
14)卸下凝胶电泳装置,取出胶板,小心移走间隔片。
15)用刮板慢慢地撬开电泳玻璃板,使空气进入到凝胶和玻璃板之间。凝胶应该仍粘在其中的一块玻璃板上。如果玻璃板分开得太快会导致凝胶被撕破或粘在两块玻璃板上。或者凝胶被扭曲变型,可以在凝胶下喷水,这可以降低凝胶的黏性。但是一定要小心,不要让凝胶从玻璃板上滑下来。
16)将黏附了凝胶的玻璃板平放在实验台上,胶面朝上。在胶上放置3张大小与凝胶相当的Whatman 3MM滤纸。
17)小心将胶板连同滤纸翻转,使滤纸在下,玻璃板朝上。
揭起玻璃板一端,小心剥下凝胶与滤纸。用塑料薄膜包裹凝胶进行真空加热干燥。
18)在不使用增感屏的条件下,凝胶膜放射自显影过夜,或用增感屏放射自显影2~3 h。
02
竞争迁移率变动分析
附加材料
未标记的特异或非特异竞争DNA片段
步骤
本方案按基本方案步骤1~8准备探针和凝胶,如下述步骤9改变结合反应的体积,再按基本方案进行步骤10~20。
标记特异或非特异竞争DNA片段,最后加入DNA结合蛋白质。在结合探针的蛋白质不是特别过量的前提下,典型的竞争剂的量可为相当于标记探针摩尔量的5x,10x或50x。
特异片段复合物对特异性和非特异性竞争剂会产生明显的差异反应。
03
抗体超变动分析
附加材料
针对DNA结合蛋白的特异性抗体
非特异的对照抗体
步骤
本方案按基本方案步骤1~8准备探针和凝胶,如下述步骤9改变结合反应的体积,再按基本方案进行步骤10~20。
9b)建立结合反应。往反应混合物中加入小体积的抗体(≤10μl)。另外一管结合反应,加入等量的非特异性对照抗体。加人抗体的量尽可能的少,但足以产生可观察效果。引人对照抗体是关键,因为抗体制剂中的盐和其他蛋白质成分对蛋白质。DNA结合物的稳定性和迁移率会有非特异性的影响。粗血清制品、纯化的多克隆抗体和单克隆抗体都能进行超变动分析。一般而言,抗体制剂越纯,结果就越清楚。
04
多元迁移率变动分析
迁移率变动分析也可用于研究DNA-蛋白质结合物的多成分组装。实际上,迁移变动分析研究的许多转录因子是同源或异源二聚体。在很多情况下,序列特异性的DNA结合蛋白(A) 往往充当其他蛋白(B和C)结合作用的平台,这些蛋白(B和C)本身并不与DNA特定序列直接结合。超变动分析可检测到初级DNA蛋白质复合物依赖于与其他因子结合形成新的离散复合物。
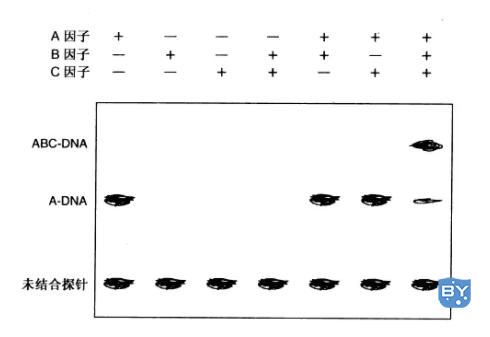
图12.2.2 多元复合物迁移率变动实验的放射自显影示意图
在此实验中,因子A与DNA是序列特异的结合。因子B和C则结合于因子A-DNA复合物。多元变动分析与基本方案没有本质的差异,然而必须注意到如下几点:
1)各种因子的浓度需足够高。虽然序列特异的DNA结合蛋白的解离常数(K)通常都很高(10-9~10-12mol/L),但随后的蛋白质蛋白质相互作用的结合常数可能较低。因此探针与蛋白质A的结合必须饱和以到达ABC复合物形成所需的浓度。
2)因子的结合未必会影响迁移率。例如,蛋白质C有可能仅是为蛋白质B与DNA蛋白质A复合物结合所必需的一种激酶。抗体超变动分析或其他蛋白质-蛋白质相互作用分析能有效地显示因子和特定复合物间的实质结合。
 文章推荐
文章推荐