
我们都知道,染色质是间期细胞核内由DNA、组蛋白、非组蛋白及少量RNA组成的线性复合结构,是间期细胞遗传物质存在的形式。与基因组直接相关的细胞活动都是在染色质水平进行的,如DNA复制、基因转录、同源重组、DNA修复等,而组蛋白的翻译后修饰,如我们今天要分享的组蛋白磷酸化,就被证明通过改变蛋白质与DNA,或蛋白质与蛋白质的相互作用来修饰染色质结构。
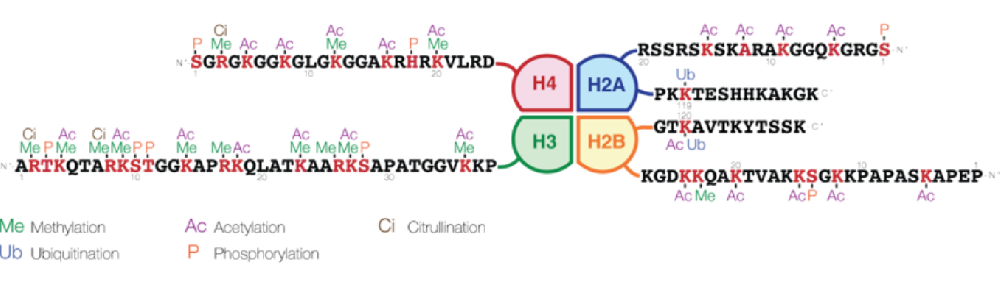
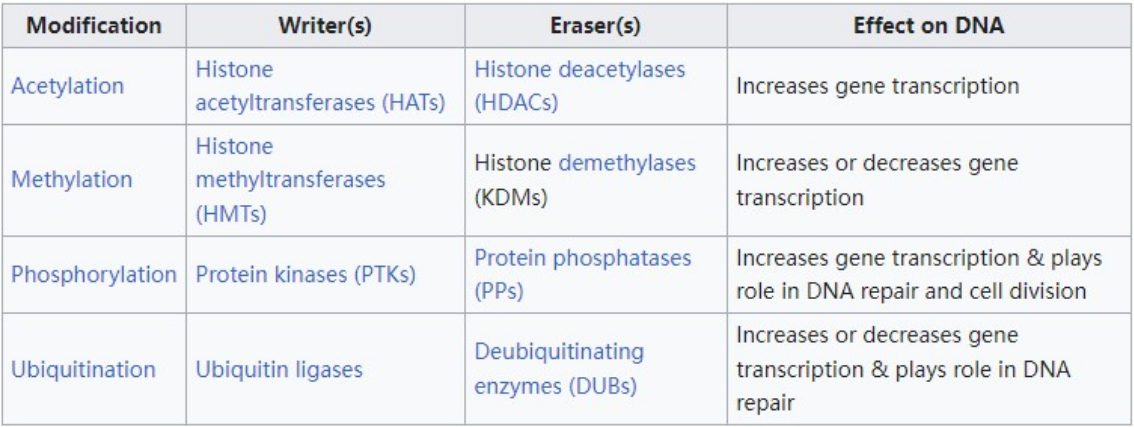
组蛋白磷酸化是在组蛋白中加入磷酸基团时发生的。蛋白激酶(PTKs)催化组蛋白的磷酸化,蛋白磷酸酶(PPs)催化组蛋白酶的去磷酸化。
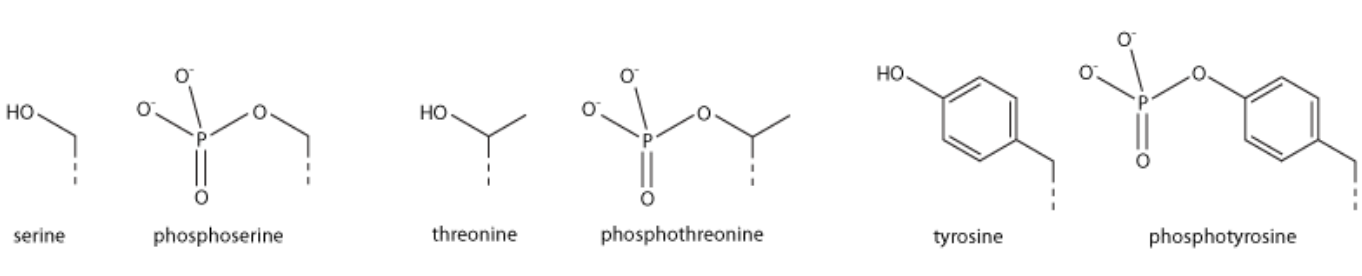
组蛋白磷酸化通常发生在丝氨酸(S)、苏氨酸(T)和酪氨酸(Y)氨基酸残基上,且主要在组蛋白的N-末端尾部。其中丝氨酸磷酸化被认为是最常见的,其次是苏氨酸。酪氨酸磷酸化相对罕见,但在大多数真核生物中处于许多蛋白质磷酸化信号通路(例如酪氨酸激酶连接受体)的顶端。
一、应用举例
就像组蛋白乙酰化一样,组蛋白磷酸化中和组蛋白上的正电荷,从而诱导常染色质并增加基因表达。既往研究发现组蛋白的磷酸化在细胞分裂过程中的DNA修复和染色质凝聚中发挥作用。 下面这篇文献,主要说明了H2AX组蛋白上S139的磷酸化,能够在修复DNA双链断裂中发挥作用。

第二篇文献与磷酸化对转录的抑制作用相关,主要调查了组蛋白的修饰是否直接影响RNA聚合酶II定向转录。作者选择已知能修饰组蛋白的相关蛋白激酶来测试它们对转录的影响,并发现应激诱导的激酶MSK1抑制RNA合成。当模板位于染色质中时,MSK1对转录的抑制最为敏感,因为不在染色质中的DNA模板对MSK1的作用具有抗性。最后的结果表明,MSK1磷酸化了丝氨酸上的组蛋白H2A,丝氨酸突变为丙氨酸阻断了MSK1对转录的抑制。因此,我们可以得知组蛋白的乙酰化可以通过抑制MSK1激酶的抑制性磷酸化来刺激转录。

如果大家对这两篇文献感兴趣,可以自行搜索查阅哦。
二、案例解析
接下来我们通过精读一篇高分文献来了解作者的研究思路,学习组蛋白磷酸化相关研究的研究方法吧。 这篇文章名为“组蛋白H3磷酸化(pH3)在胶质母细胞瘤(GBM)中的作用:指导在抗GBM治疗中使用激酶抑制剂的新理论依据”,影响因子为12.4。

GBM是成人脑肿瘤中最常见的恶性肿瘤之一,死亡率高,预后差。目前的标准治疗包括手术切除、放疗和化疗,使用替莫唑胺可以在一定程度上提高患者的生存率。但由于GBM的异质性,多种治疗方法都会产生耐药性,导致肿瘤复发。而替莫唑胺耐药的主要原因之一是O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)。 组蛋白翻译后修饰(PTMs)是调节染色质的多种过程的重要组成部分,其中DNA甲基化,特别是启动子区域中的MGMT甲基化可预测GBM治疗中的烷基化剂(如替莫唑胺)的效益。此外,组蛋白磷酸化在细胞分裂和调亡过程中对DNA修复结构、转录和染色质压缩起着重要作用,因此显得至关重要。然而,对于组蛋白磷酸化在人类癌症中的预后价值知之甚少。对此,作者展开了研究。
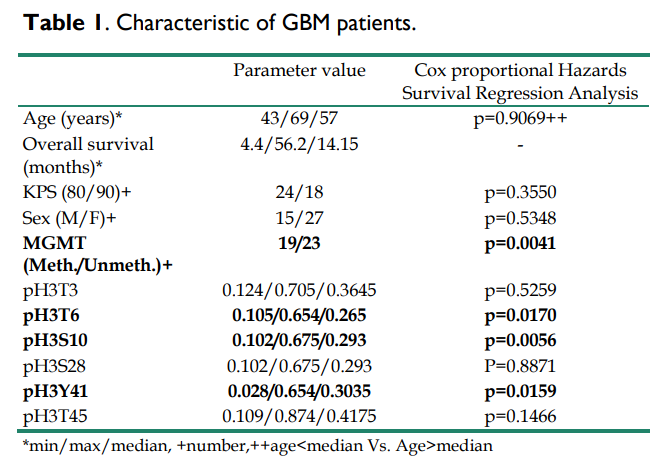
①首先作者对GBM患者的临床和生物学特征进行了评估。 作者对采集的42份GBM患者样本进行了酶联免疫吸附反应(ELISA)分析,发现患者的中位年龄为57岁,总生存期(OS)中位数为14.15个月,且MGMT甲基化患者的总体生存时间更长。
②接着作者进一步测试了GBM中pH3的水平,从图中我们可以看出所有研究的GBM样本(PCTC-GBM)中都出现了组蛋白磷酸化,且从整体水平来看,存在2-3种H3组蛋白磷酸化的样本较多。
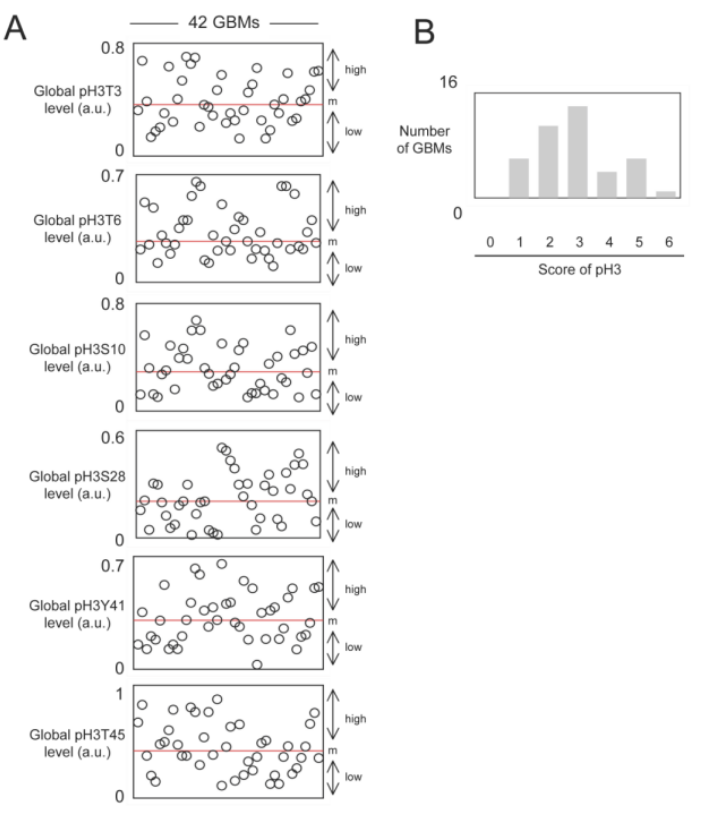
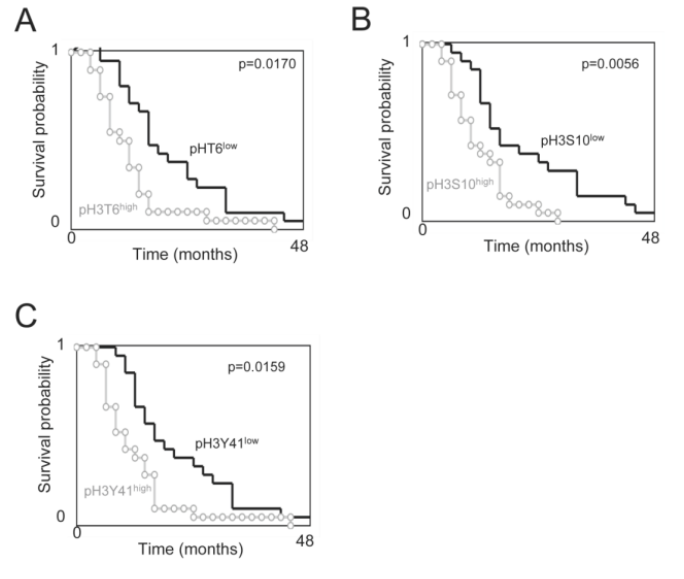
③下面作者分析了pH3是否对GBM患者的OS具有预测价值。作者首先根据在肿瘤上发现的每种组蛋白磷酸化水平,将患者分为两组。组蛋白磷酸化水平高于所有GBM样本中位数的GBM样本被纳入高磷酸化水平亚组。相反,组蛋白磷酸化水平低于所有GBM样本中位数的GBM样本被纳入低磷酸化水平的亚组,再选用占比较多的三个磷酸化位点,即T6、S10、Y41,采用生存曲线(Kaplan-Meier曲线)法估计了总生存曲线,并与cox比例风险生存回归进行比较后,作者发现肿瘤中pH3T6、pH3S10或pH3Y41水平高的患者与肿瘤中pH3T6、pH3S10和pH3Y41水平不高的患者的OS差异显著(p=0.0170、p=0.0056和p=0.0159)。换句话说,这些数据表明,pH3T6、pH3S10或pH3Y41的高水平是GBM患者预后不良的标志。
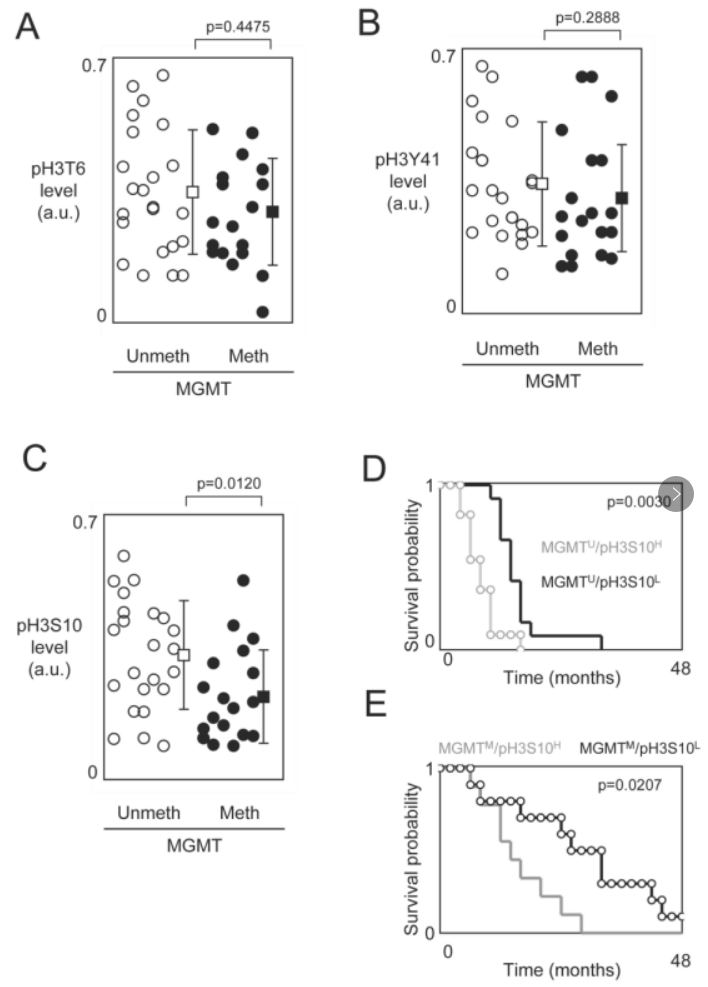
④在此前已有研究证明MGMT启动子甲基化是替莫唑胺-放射治疗(TMZ+Irad treatment)获益的预测标志物,接下来作者对与H3T6、H3S10和H3Y41磷酸化水平相关的预后值是否受MGMT甲基化状态的影响做出了研究。作者先分析了出现MGMT基因甲基化的GBM是否也出现了高水平的pH3T6、pH3S10或pH3Y41。在出现未甲基化和甲基化MGMT基因的GBM患者中,pH3T6和pH3Y41之间没有统计学差异(图A、B),因此pH3T6和pH3Y41可作为独立于MGMT甲基化状态的另一个GBM患者预后因素。相反,出现MGMT基因甲基化的GBM患者的pH3S10水平很低(图C)。这些数据表明,有一部分患者的GBM具有两种生物标志(即甲基化的MGMT基因和pH3S10)的特征。在这一结果的支持下,作者接下来比较了根据MGMT甲基化状态【甲基化(M)或未甲基化(U)】和pH3S10水平【低(L)或高(H)】的患者的OS进行了分层。再通过Kaplan-Meier曲线和Cox比例危险生存回归分析:肿瘤有MGMT未甲基化/H3S10高磷酸化的患者与肿瘤有MGMT未甲基化/H3S10低磷酸化的患者之间的OS有显著差异,肿瘤有MGMT甲基化/pH3S10高磷酸化患者与肿瘤有MGMT甲基化/pH3S10低磷酸化的患者之间的OS也有显著差异(图D、图E),且MGMT未甲基化/H3S10低磷酸化及MGMT甲基化/H3S10低磷酸化的患者有更长的生存时间。
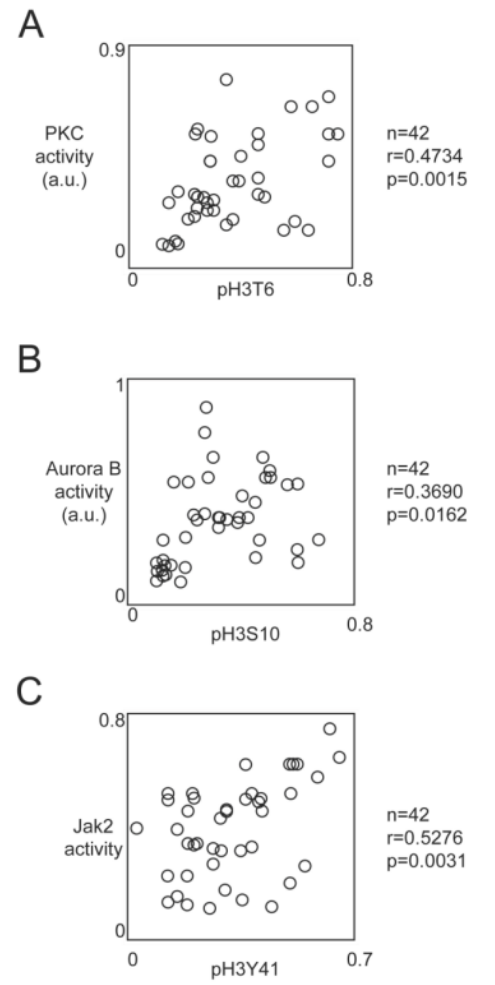
⑤根据之前的文献报道:H3T6、H3S10和H3Y41的磷酸化可能分别是由PKCβ、Aurora-B、Jak2激酶引起的。因此,作者分析了这些激酶的活性是否与组蛋白H3相应的磷酸化水平相关,通过皮尔逊相关性检验表明:pH3T6与PKCβ活性相关,pH3S10与Aurora-B活性相关,pH3Y41与Jak2活性相关,且都是呈正相关的。
⑥在之前的实验结果中,我们得知pH3T6、pH3S10或pH3Y41水平是GBM患者预后不良的标志,因此,作者产生了两个疑问,第一,高水平的pH3T6、pH3S10或pH3Y41是否与抗GBM治疗中使用的TMZ+Irrad疗法的耐药表型有关;第二,这种表型的出现是否可以通过预处理消除高水平的pH3T6、pH3S10或pH3Y41而逆转。为了解决这两个问题,作者首先分析了TMZ+Irad处理PCTC-GBM来源的原代培养肿瘤细胞诱导的细胞死亡百分比,再在对这些肿瘤细胞进行激酶抑制剂预处理或未处理后,发现激酶抑制剂与PCTC-GBM中存在的高水平pH3T6、pH3S10或pH3Y41有关(图A)。 针对PCTC-GBM中存在的高水平pH3T6、pH3S10或pH3Y41的激酶,作者选择了Enzastaurin(PKCβ抑制剂)、AZD1152(Aurora-B抑制剂)、AZD1480(Jak2抑制剂)进行相应处理,发现Enzastaurin预处理显著降低了pH3T6水平(图B),AZD1152处理会显著降低pH3S10水平(图C),AZD1480处理则会显著降低pH3Y41水平(图D),这些结果均与TMZ+Irad处理敏感性显著增加有关,因此,我们可以得知:GBM标准疗法抵抗与这三个H3位点磷酸化相关,当用对应的激酶抑制剂处理后治疗效果提升。
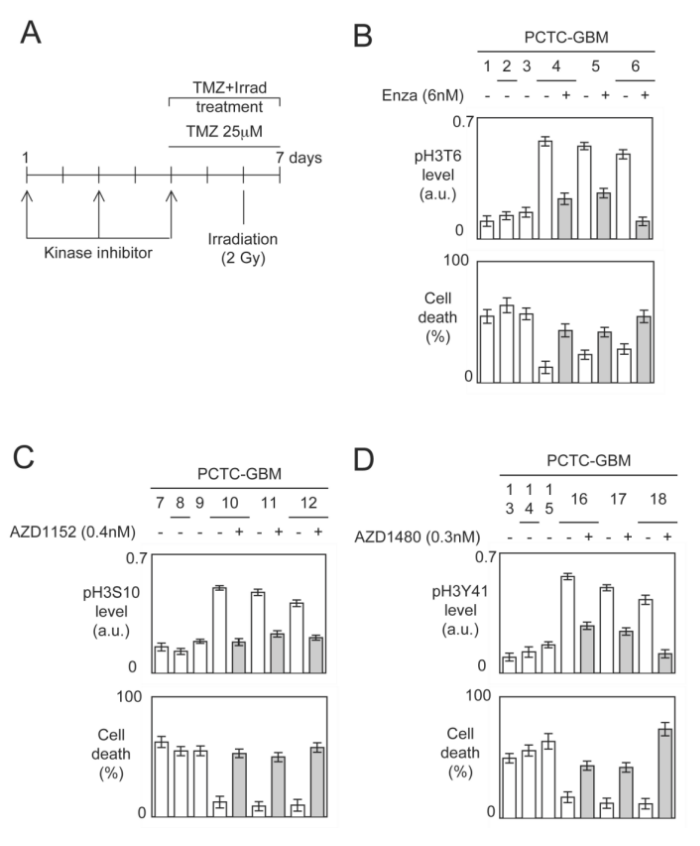
⑦随后,作者将患者根据H3这三个磷酸化位点进行分层,发现磷酸化的这3个H3位点越多,患者的生存时间越短。同样的,当给出特定的激酶抑制剂时,特定位点的H3磷酸化被抑制,细胞死亡增加。
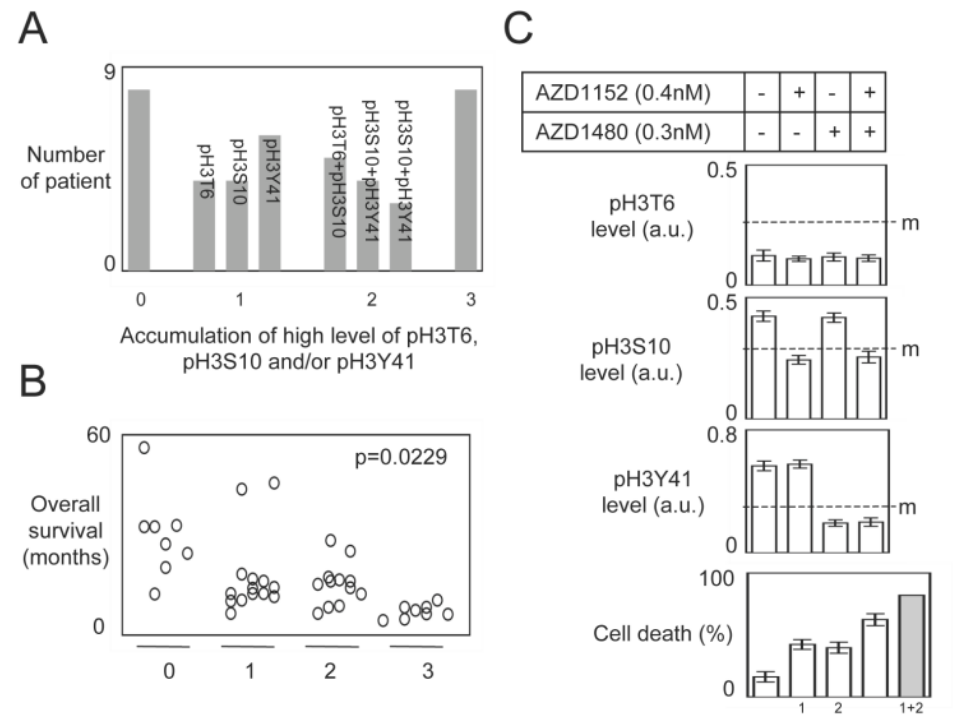
总的来说,这篇文章发现了H3T6、H3S10、H3Y41磷酸化与GBM的不良预后及治疗抵抗相关,且这三个位点的H3组蛋白磷酸化可以分别被PKCβ、AuroraB、JAK2抑制剂抑制。
 文章推荐
文章推荐