
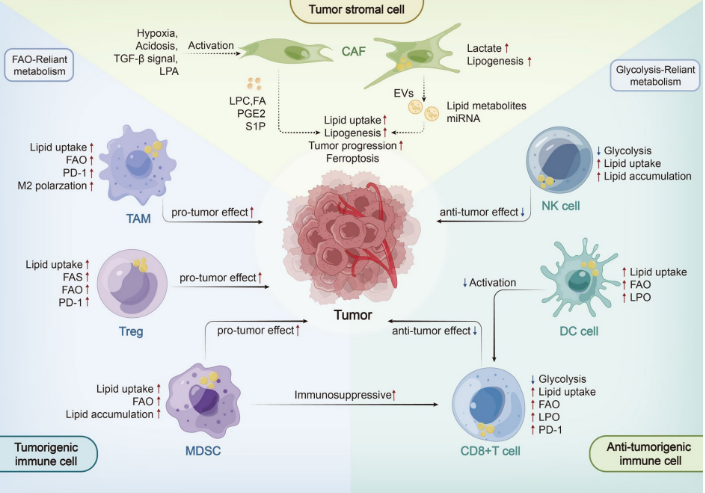
代谢重编程是癌症研究的一个重要领域,被列为癌症的一个标志,且大多数关于代谢重编程的研究都来自于癌症模型和癌症样本,肿瘤微环境中包含神经元、血管内皮细胞、成纤维细胞和巨噬细胞等多种细胞。为了适应缺氧和营养缺乏,肿瘤细胞必须重新编程代谢途径,以满足肿瘤细胞的能量、生物合成和氧化还原需求的过程称为代谢重编程(Metabolic reprogramming)。
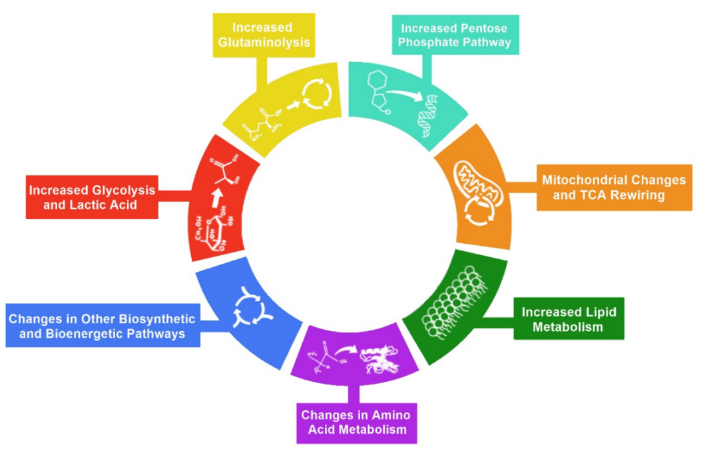
代谢重编程的七个标志:
糖酵解增加
谷氨酰胺水解增加
磷酸戊糖途径增加
线粒体变化和TCA重新布线
脂质代谢增加
氨基酸代谢变化
其他生物合成和生物能量途径变化
这些标志在肿瘤的发生发展和病毒发病机制中起着至关重要的作用。因此,我们需要充分了解这些标志的具体作用机制。
一、糖代谢的作用机制
在正常细胞中,葡萄糖(glucose)通过糖酵解(glycolysis)的酶促反应转化为丙酮酸(pyruvate)。丙酮酸随后转化为乙酰辅酶A(acetyl-CoA),为三羧酸循环(TCA循环)提供燃料,这个过程也称为克雷布斯Krebs循环。
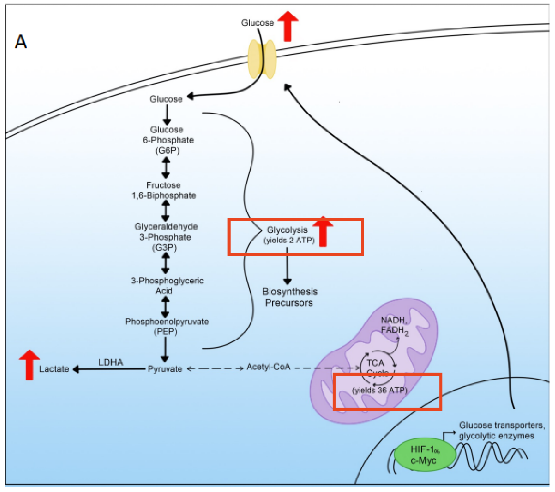
然后通过TCA循环,细胞产生烟酰胺腺嘌呤二核苷酸(NAD)+氢(H),即NADH;和黄素腺嘌呤二核苷酸+2个氢(2H),即FADH2。这些产物通过氧化磷酸化(OXPHOS)在线粒体呼吸链中产生36个三磷酸腺苷(ATP)形式的细胞能量分子。
在代谢重编程中,即使在氧气存在的情况下,细胞也可以利用糖酵解而不产生丙酮酸来产生乳酸。这种在氧气存在下的糖酵解现象被称为有氧糖酵解(aerobic glycolysis)。
由于糖酵解只产生两个ATP分子,细胞必须通过上调糖酵解的葡萄糖量来补偿ATP的减少。因此,细胞首先需要增加对葡萄糖的摄取。许多细胞通过激活葡萄糖转运蛋白来实现这一点。此外,代谢重编程细胞表现出糖酵解酶的增加,以促进进一步的糖酵解。经历代谢重编程的细胞利用HIF-1α和C-Myc转录因子(糖酵解的主要诱导物)上调葡萄糖转运蛋白和糖酵解酶。
从图中我们可以看到,许多糖酵解代谢产物被用作所需细胞产物生物合成的构建块。其中一种代谢产物——葡萄糖-6-磷酸(G6P),在磷酸戊糖途径(PPP)中被消耗,然后产生核苷酸合成的前体。另一种有益的糖酵解代谢产物是磷酸二羟基丙酮(DHAP),用于脂质合成。
当然,其他代谢物也参与了氨基酸生产和大分子合成等过程。这些代谢物在细胞维持的其他方面的重要性使得增加糖酵解成为代谢重编程的重要一步,也成为了代谢重编程相关疾病的治疗靶点。
接着,我们从这幅图中可以看到PPP的作用机制。氧化臂产生NADPH,将G6P转化为5-磷酸核酮糖,通过核酸合成产生核苷酸。PPP的另一个轴是非氧化轴,由G6P生成果糖-6-磷酸(F6P)和甘油醛-3磷酸(G3P)。这些产物可以参与糖酵解和其他代谢途径。
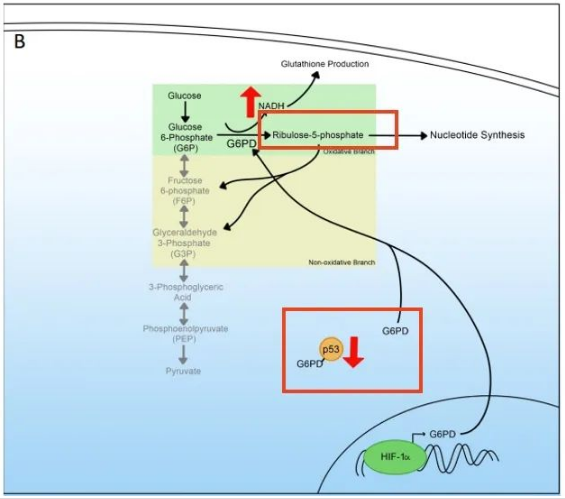
由于对核苷酸的需求增加,第一个分支对于向细胞提供5-磷酸核酮糖是必不可少的。因此,生成的NADPH用于谷胱甘肽(glutathione)的产生,保护细胞免受氧化应激和细胞凋亡。NADPH也被细胞用于脂质和其他大分子的生物合成,因为NADPH的增加有助于整体代谢重编程。
与代谢重编程相关的PPP增加是PPP中酶表达增加的结果。代谢重编程过程中必需升高的酶之一是葡萄糖-6-磷酸脱氢酶(G6PD),它是PPP的第一个酶,有助于将G6P转化为5-磷酸核酮糖。
G6PD的酶活性受肿瘤抑制蛋白的调控,在正常细胞中,p53与G6PD结合,阻止其形成异源二聚体并具有酶活性。在p53活性下调的细胞中,如癌细胞,G6PD不再受到负调控,并有助于代谢重编程。在转录方面,G6PD可通过HIF-1α蛋白诱导。
此外,线粒体也是许多代谢途径发生的重要场所。它们对于维持细胞内稳态的许多方面至关重要。线粒体内代谢途径的重新布线涉及许多代谢物,如柠檬酸盐(citrate)、天冬氨酸(aspartate)、琥珀酸(succinate),都是TCA循环中间体。
1. TCA循环中间体——柠檬酸盐(citrate)
柠檬酸盐是TCA循环中的第一个中间体。我们可以看到,在代谢重编程过程中,柠檬酸盐从线粒体向细胞质的输出增加。这种输出是通过线粒体柠檬酸盐载体(CIC)实现的,该载体将柠檬酸盐交换为苹果酸盐(malate)。一旦出口,柠檬酸盐就用于脂肪酸的生物合成。除了脂肪酸生物合成外,胞质柠檬酸盐还产生乙酰辅酶A和草酰乙酸,这些物质可以进一步转化为苹果酸,并通过CIC转运回线粒体。
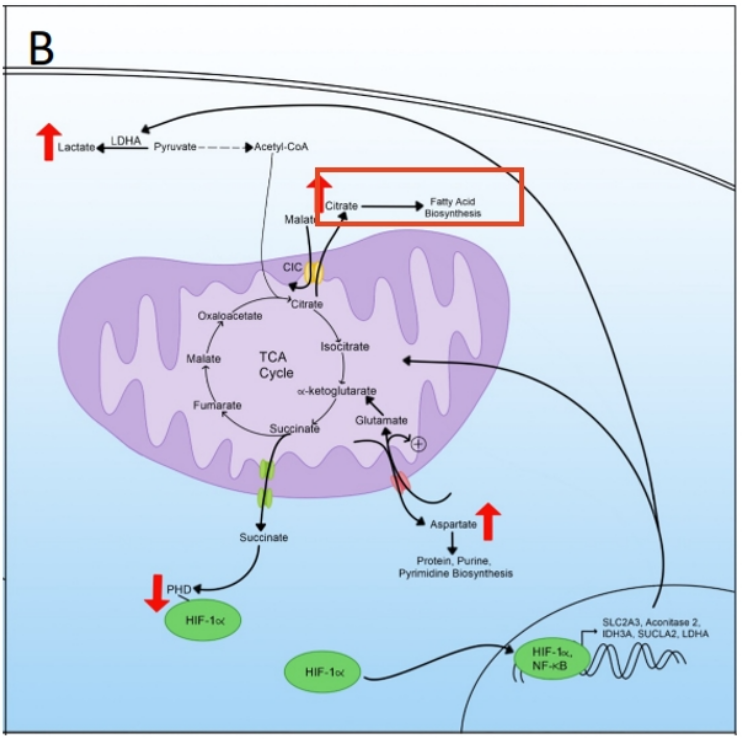
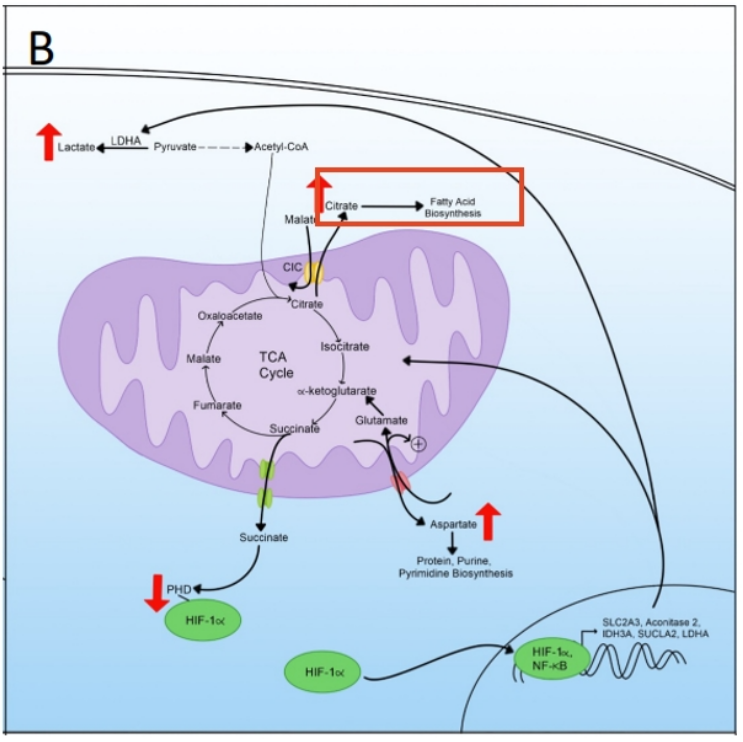
2. TCA循环中间体——天冬氨酸(aspartate)
另一个受这种重新布线影响的TCA循环中间体是天冬氨酸,其中向胞质溶胶的产生和输出发生了改变。天冬氨酸通过线粒体天冬氨酸/谷氨酸载体(AGC1和AGC2)移动到胞质溶胶以交换谷氨酸和质子。然后,新进入的谷氨酸可以作为α-酮戊二酸进入TCA循环,作为一种无机底物,在缺乏丙酮酸的情况下继续为TCA提供燃料,这是代谢重编程的特征。天冬氨酸的输出对蛋白质、嘌呤和嘧啶的生物合成至关重要,也是肿瘤细胞中这些物质生物合成的限速事件。天冬氨酸的转运是苹果酸/天冬氨酸穿梭体(MAS)运作的一部分,对再生用于糖酵解的胞浆NAD+至关重要。
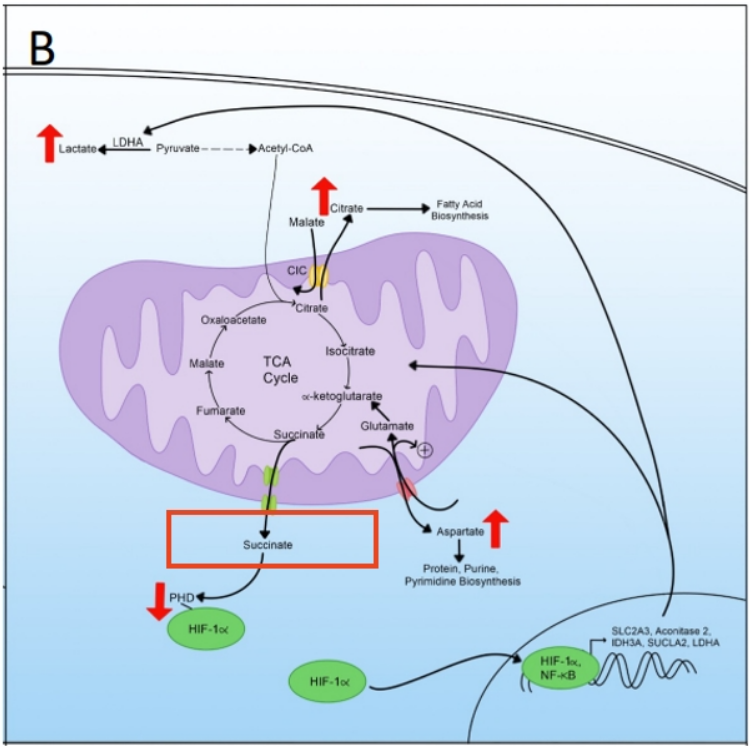
3. TCA循环中间体——琥珀酸(succinate)
琥珀酸是连接TCA循环重新布线和代谢重编程的信号信使,它通过二羧酸载体从内部线粒体运输出来,再通过电压依赖性阴离子通道进入胞质溶胶。然后,胞质琥珀酸可以与氧依赖性脯氨酰羟化酶(PHD)相互作用并抑制其降解,该酶负责靶向HIF-1α。因此,当琥珀酸转移出TCA循环时,它有助于HIF-1α的增加,从而促进代谢重编程。
二、脂质代谢的作用机制
脂质是癌症和病毒产生新细胞器、细胞和病毒体的重要组成部分。脂质合成是一个涉及多个步骤、多酶参与的过程,通常从乙酰辅酶A开始,到脂肪酸结束。
在代谢重编程细胞中,用于脂质合成的大多数乙酰辅酶A来自TCA循环产生的柠檬酸盐,并已从线粒体中运输出来。在胞质溶胶中,柠檬酸盐可以转化回乙酰辅酶A并进行脂质合成。
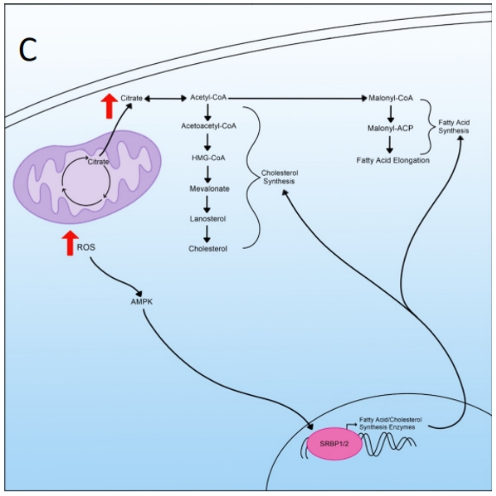
胆固醇是另一种在代谢重编程过程中增加的脂质。胆固醇合成途径甲羟戊酸酯是脂质合成的另一个分支,从乙酰辅酶A开始,以羊毛甾醇转化为胆固醇结束。胆固醇合成是膜的关键组成部分,控制着膜的流动性和脂筏的形成。胆固醇激活Ras-Raf信号通路,该通路通常被病毒和癌症用来操纵细胞转录。
甾醇调节元件结合蛋白(SREBPs)是一个转录因子家族,控制着许多参与脂肪酸和胆固醇合成的酶。两种不同的SREBP参与脂质合成的这种调节:第一种SREBP调节脂肪酸合成,而第二种SREBP调节胆固醇合成。
SREBP由AMP活化蛋白激酶(AMPK)信号控制,在代谢重编程中,ROS积累增加可以激活AMPK,从而增加SREBP的转录,使得脂质和胆固醇合成增加。
三、氨基酸代谢的作用机制
为了使代谢重编程细胞以高速率产生生物量,需要合成氨基酸,用作碳源、氮源或电子转运蛋白。细胞还可以使用支链氨基酸(BCAA)、亮氨酸(leucine)、异亮氨酸(isoleucine)和缬氨酸(valine)来为TCA循环提供燃料。
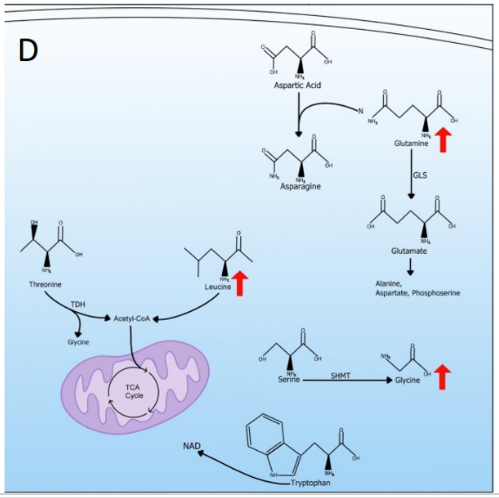
在BCAA中,亮氨酸随着代谢重编程而升高,并转化为乙酰辅酶A,然后进入TCA循环。除了BCAA,苏氨酸也可以被苏氨酸脱氢酶(TDH)分解代谢,产生甘氨酸和乙酰辅酶A,随后也可以进入TCA循环。
氨基酸除了可以作为生产乙酰辅酶A用于TCA循环的替代方法外,还可以作为生物质材料,是合成蛋白质、脂质和核酸所必需的。谷氨酰胺用于合成许多非必需氨基酸(NEAAs)。谷氨酰胺通过谷氨酰胺酶(GLS)催化转化为谷氨酸,然后谷氨酸进一步转化为其他氨基酸,如丙氨酸、天冬氨酸和磷酸丝氨酸。
精氨酸(arginine)是另一种用作其他NEAA前体的氨基酸。精氨酸的增加促进了脯氨酸的合成,也可作为代谢重编程细胞中谷氨酸的另一来源。另一种在核苷酸生物合成中很重要的氨基酸代谢途径是丝氨酸通过丝氨酸羟甲基转移酶(SHMT)将丝氨酸转化为甘氨酸,这为从头合成核苷酸提供了一碳甲基库。
除了NEAA合成外,氨基酸代谢还为脂质生物合成提供碳原子,并有助于乙酰辅酶A的供应。氨基酸代谢也为核酸合成贡献氮和碳,并且是嘌呤合成所必需的。必需氨基酸色氨酸可用于NAD从头合成,以补充NAD水平,从而继续促进代谢氧化还原反应的增加。
总之,氨基酸代谢对于代谢重编程至关重要,通过许多不同的途径,从替代能源到为蛋白质、脂质和核苷酸的合成提供材料。
上面我们还提到了谷氨酰胺,它被认为是体内最丰富的氨基酸,是蛋白质、核苷酸和脂质合成所必需的。谷氨酰胺分解(glutaminolysis)是多种酶通过α-酮戊二酸2-KG将谷氨酰胺(glutamine)转化为TCA循环代谢产物的过程。
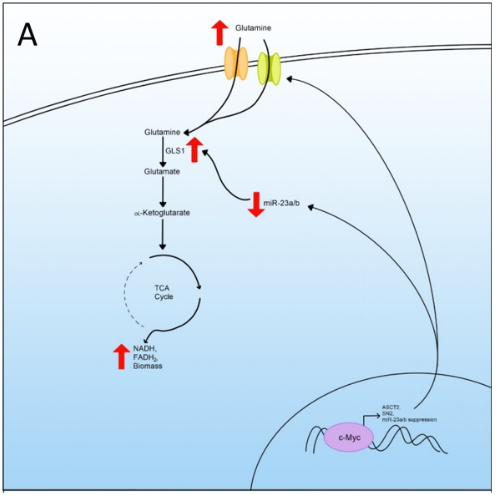
在代谢重编程细胞中,由于丙酮酸被转移而不进入TCA循环,谷氨酰胺被用来补充TCA循环中的重要代谢产物以合成生物物质。谷氨酰胺通过线粒体OXPHOS持续产生NADH、FADH2和用于ATP产生的电子作为TCA循环的再补性底物。
为了触发谷氨酰胺裂解,细胞依赖C-Myc的作用来上调谷氨酰胺转运蛋白和谷氨酰胺裂解所需的酶。C-Myc蛋白增加谷氨酰胺转运蛋白2(ASCT2)和SN2的表达,导致谷氨酰胺的细胞摄取增加。
C-Myc还通过抑制miR-23a/b来增加谷氨酰胺分解,miR-23a/b对谷氨酰胺分解所需的GLS1的表达进行负调控。miR-23a/b的抑制允许GLS1的表达,GLS1诱导谷氨酰胺转化的谷氨酸量,从而补充TCA循环。
 文章推荐
文章推荐