
眼睛是人体重要的感觉器官。据统计,2019年全球共有7.1亿人患有各种形式的眼病,我国眼病患者约1.9亿(占比27%),居世界之首。眼病不仅给患者带来不同程度的视觉损伤或丧失,导致生活和工作不便,还会加重家庭和社会的负担。那么关于眼病有什么课题设计思路呢?
下面,我们将结合一篇发表于中科院1区期刊Science Translational Medicine,影响因子为17.1的高分文献来具体讲解眼病相关的课题设计思路,文献名为《肠道许可的β7+ CD4+ T细胞导致青光眼视网膜神经节细胞进行性损伤》,希望能给大家带来不一样的灵感。

【文章题目】:肠道许可的β7+ CD4+ T细胞导致青光眼视网膜神经节细胞进行性损伤
【发表期刊】:Science Translational Medicine
【影响因子】:IF=17.1
【发表日期】:2023.08
一、研究背景
①降低眼压(EIOP)触发的自身免疫成分参与了青光眼的继发性神经变性。
②T细胞在进行性青光眼神经损伤的发病机制中发挥重要作用。
③肠道内容物提取物可以交叉激活CD4+ T细胞与视网膜特异性T细胞受体,但是潜在机制尚不清楚。
④肠道屏障损伤可导致小鼠视网膜内层神经元损伤,并且表达肠归巢分子β7的CD4+ T细胞在其中扮演了至关重要的病理损伤角色。
二、技术路线
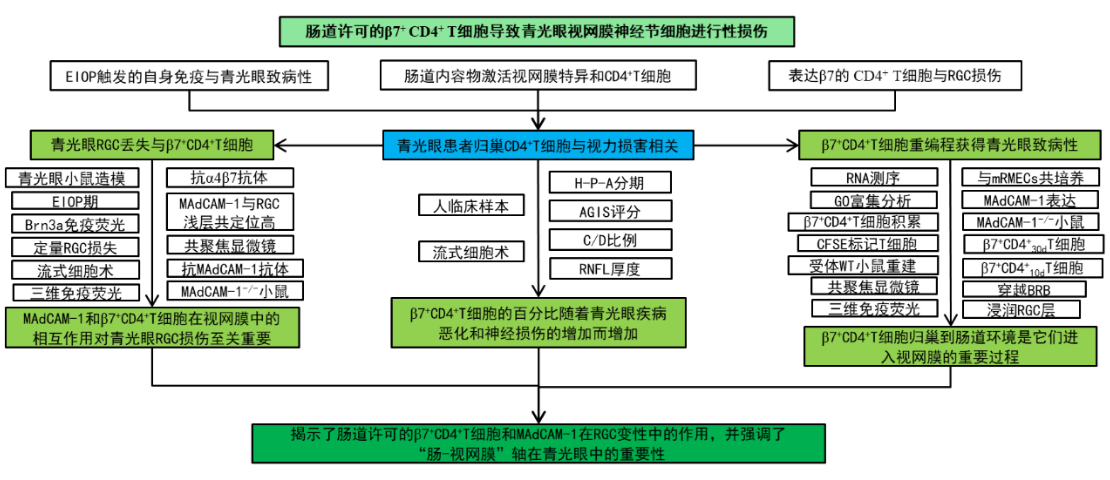
三、研究结果
1.青光眼患者归巢CD4+ T细胞百分比与视力损害相关
CD4+ T细胞能表达一组表面分子,在其上印记肠道归巢特异性,可以迁移到肠道。β7整合素是记录最充分的肠道归巢标志物。我们可以从图1A看到,为了研究肠道归巢CD4+ T细胞在青光眼中的作用,作者收集了临床血液样本进行流式细胞术,以确定表达β7的群体在CD4+ T细胞总数中的百分比。图1B研究结果发现,青光眼组中β7+ CD4+ T细胞的百分比增加。
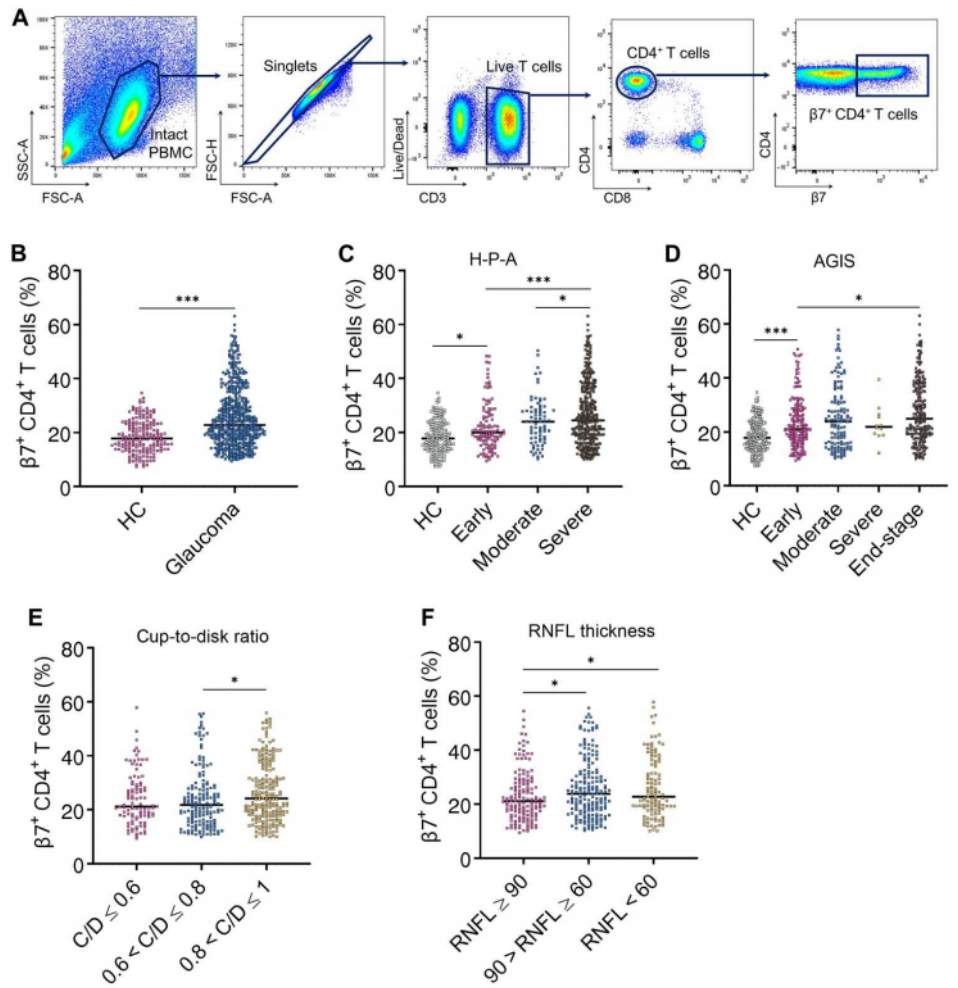
如图1B~C所示,作者根据H-P-A分期系统,将患者分为早期、中度和重度三组,然后又根据高级青光眼干预研究评分系统(AGIS),将患者分为早期、中度、重度和终末期四组,最终发现在两种分期系统中,β7+ CD4+ T细胞的百分比随着疾病严重程度的增加而增加。另外,从图1E~F可以看出,作者还根据C/D占比或视网膜神经纤维层(RNFL)厚度分层将患者分组,结果表明β7+ CD4+ T细胞的百分比随着C/D的增加和RNFL变薄而增加。
2.进行性青光眼RGC损伤与小鼠循环β7+ CD4+ T细胞增加有关
然后,作者在小鼠的双眼前房注射了微珠悬浮液,诱导青光眼模型。图2A显示,该模型表现出约28天的EIOP期和延长的RGC变性。图2B和2C则显示,使用Brn3a免疫荧光染色对视网膜平板支架中的RGC损失进行量化。此外,我们可以从2D实验结果发现,注射微珠后30~60天,RGC损失逐渐恶化;从图2E则可以发现进行性青光眼小鼠的循环β7+ CD4+ T细胞明显增加。
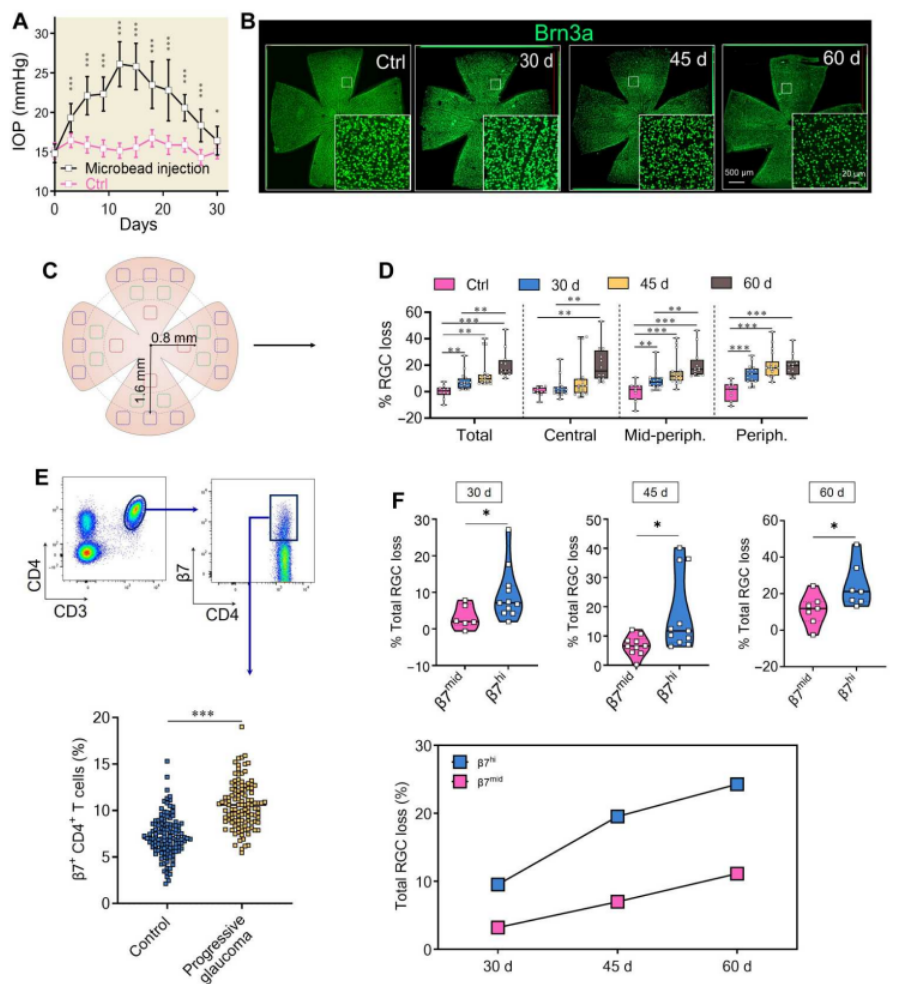
接下来,作者将进行性青光眼小鼠分为两组:β7+ CD4+ T细胞≥10.6%的β7hi小鼠;β7+ CD4+ T细胞<10.6%的β7mid小鼠。如图2F所示,在所有三个时间点,β7hi组小鼠的RGC损失均高于β7mid组小鼠。
3.青光眼中β7+ CD4+ T细胞促进RGC进行性丢失
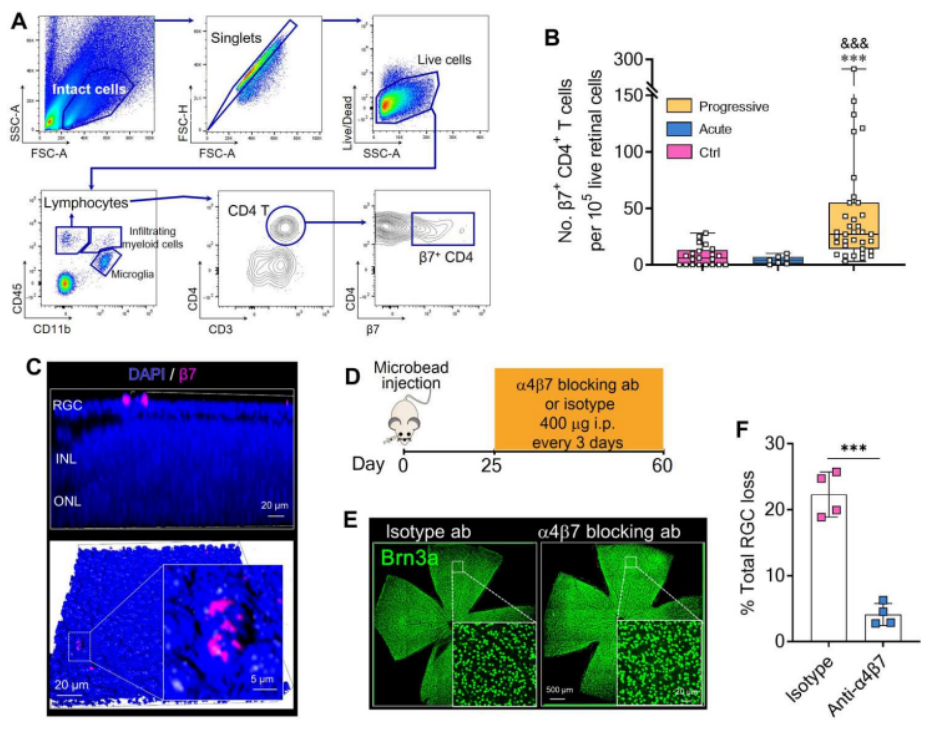
为了研究循环中的β7+ CD4+ T细胞是否可以迁移到视网膜中,如图3A所示,作者使用流式细胞术检测对照组和青光眼小鼠的视网膜组织。图3B结果显示,对照组和急性青光眼小鼠(30天前)视网膜中β7+ CD4+ T细胞的百分比较低,而进行性青光眼小鼠的视网膜中β7+ CD4+ T细胞的百分比较高。接着,我们可以从图3C进行性青光眼小鼠的RGC层中发现β7+细胞。此外,在图3D~F中,为了证实β7+ CD4+ T细胞在青光眼中的致病作用,作者在注射微珠后25~60天内静脉注射抗α4β7抗体;且阻断α4β7减少了青光眼RGC丢失。这些结果表明,阻断β7+ CD4+ T细胞向视网膜的募集可以改善视网膜的神经炎症,防止RGC丢失。
4.MAdCAM-1的异位视网膜表达是进行性RGC损伤所必需的
作者团队在结肠炎诱导的视网膜神经变性模型中证实了MAdCAM-1介导的β7+ T细胞募集进入视网膜,其他实验室也证实了MAdCAM-1对中枢神经系统炎症的作用。如图S5所示,作者首先在青光眼小鼠中观察到CD4+ T细胞与视网膜内皮细胞表达的MAdCAM-1共定位。图4A~C结果显示,青光眼小鼠中表达MAdCAM-1的视网膜血管数量更多;视网膜内脉管系统由位于不同视网膜深度的3个相互连接的平行血管丛层组成,支持不同层视网膜神经元的代谢需求。另外,我们还可以从图4D~E的结果观察到,在青光眼小鼠视网膜的3个神经丛层中,表达MAdCAM-1的血管数量都有所增加,但MAdCAM-1在与RGC层共定位的浅层中最高。
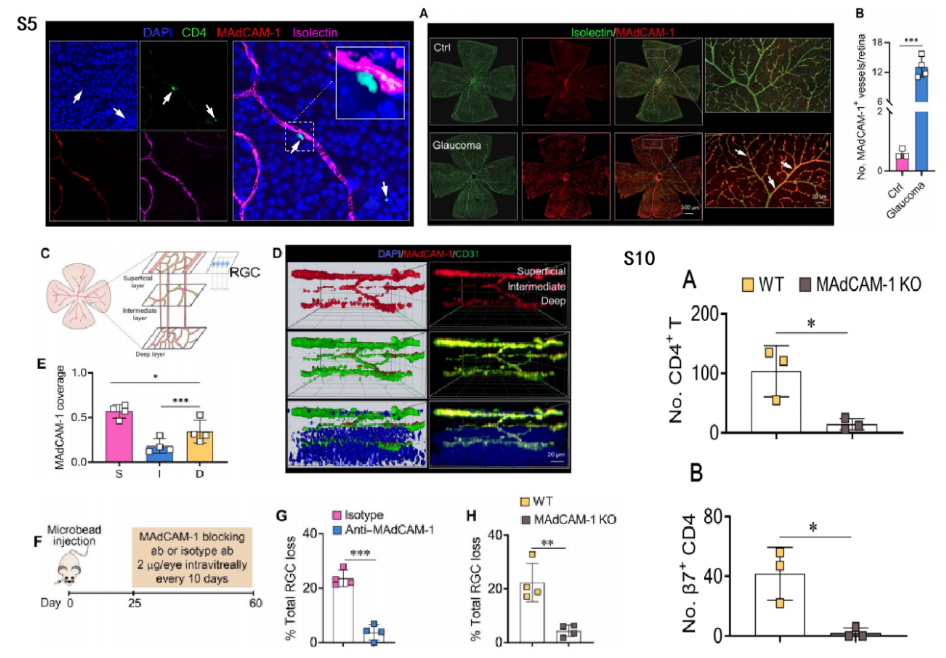
图4F~G结果显示,在注射微珠后第25~60天,通过玻璃体注射抗体阻断视网膜MAdCAM-1,能减少青光眼小鼠的RGC损失。另外从图4H、图S10A~B结果可以发现,与EIOP诱导的WT小鼠相比,注射微珠60天后,MAdCAM-1−/−小鼠的RGC损失和T细胞浸润显著降低。这些数据表明MAdCAM-1和β7+ CD4+ T细胞在视网膜中的相互作用对青光眼RGC损伤至关重要。
5.在小鼠中β7+ CD4+ T细胞经过重编程获得青光眼致病性
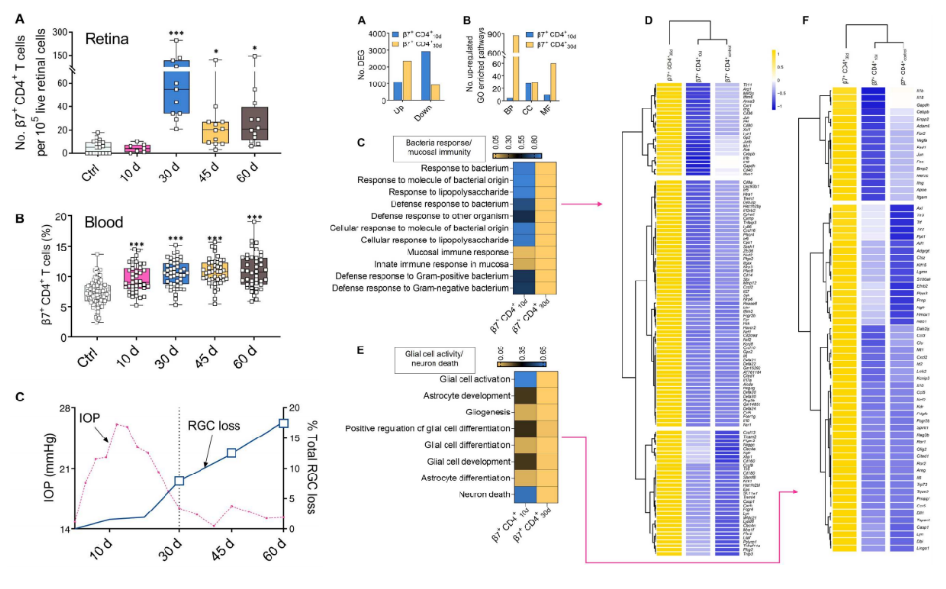
接着,我们可以从图5A~C看到,作者先发现了在EIOP诱导的小鼠外周血中循环β7+ CD4+ T细胞先于视网膜积累。然后,作者针对第10天和第30天的小鼠纯化的β7+ CD4+ T细胞进行了RNA测序。图6A~B结果显示,β7+ CD4+ 30d T细胞比β7+ CD4+ 10d T细胞的基因表达谱发生了更多的变化。具体从图6C~D可以看到,β7+ CD4+ 30d T细胞中富集的生物过程(bp)包括细菌应答、白细胞迁移、粘膜免疫和炎症反应。这表明CD4+ T细胞需要来自肠道微生物群的激活信号才有资格诱导青光眼变性,而由粘膜炎症引发的β7+ CD4+ T细胞具有侵入视网膜的能力。此外,图6E~F显示,β7+ CD4+ 30d T细胞上调了一些参与神经胶质活性和神经元死亡的基因。这说明它们可能与视网膜胶质细胞和神经元相互作用。这些结果表明,EIOP诱导的β7+ CD4+ T细胞在注射微珠后的第10天至第30天对其基因表达谱进行了重编程,这可能催化了β7+ CD4+ 30d T细胞的青光眼致病性。
6.β7+ CD4+ 30d T细胞诱导MAdCAM-1在视网膜血管中的表达,促进其进入视网膜
根据RNA-seq结果,作者开始进一步验证β7+ CD4+ 30d T细胞是否可以介导青光眼RGC损伤,如图7A所示,作者从青光眼小鼠中分离出β7+ CD4+ 30d或β7+ CD4+ 10dT细胞,用CFSE标记后,经尾静脉转移至WT受体小鼠。图7B~C结果显示,重建4天后,在β7+ CD4+ 30dT细胞受体的视网膜中可以观察到明显的血管外CFSE标记细胞,并且侵入性β7+ CD4+ 30dT细胞优先浸润RGC所在的浅层。这表明β7+ CD4+ 30dT细胞确实具有青光眼的致病性。
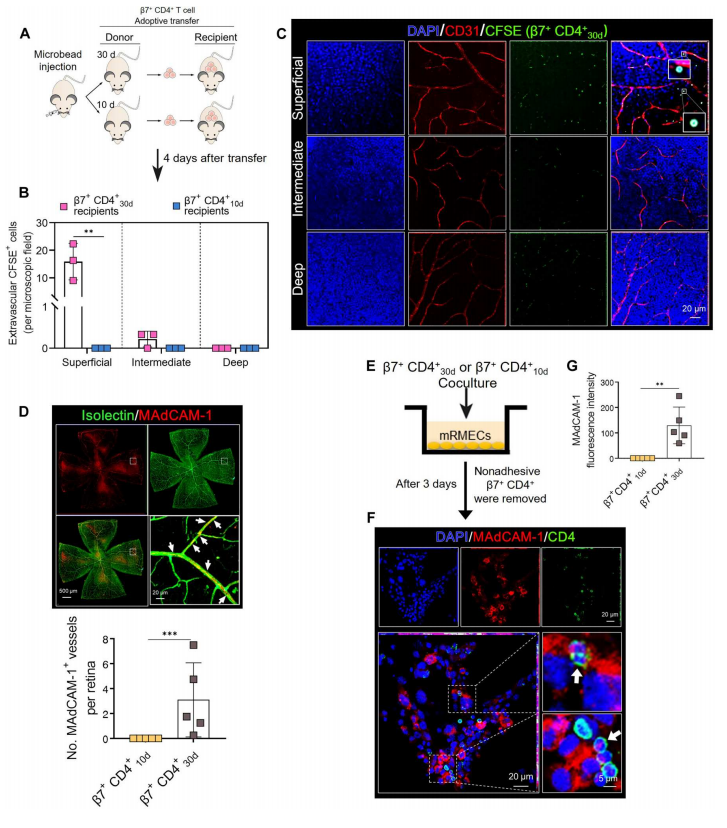
此外,可以从图7D观察到在β7+ CD4+ 30d T细胞受体的视网膜微血管上表达MAdCAM-1。并且与小鼠视网膜微血管内皮细胞共培养的β7+ CD4+ 30d T细胞,如图7E~G所示,在体外同样诱导MAdCAM-1表达。这些数据表明,EIOP诱导的β7+ CD4+ T细胞经历了功能性重编程,并变得有能力穿越血视网膜屏障,至少一部分是通过MAdCAM-1在视网膜微血管中的诱导。
7.β7+ CD4+ T细胞归巢到肠道环境是它们进入视网膜的重要过程
造模后,作者发现β7+ CD4+ T细胞在肠道内的占比在第10天增加,早于视网膜,如图8A~B所示,这表明EIOP诱导的β7+ CD4+ T细胞可能在到达视网膜之前走上“肠道弯路”。为了进一步验证,作者在图8C中对β7+ CD4+10d T细胞进行了继代转移实验,并在转移后第4天检测到CFSE标记细胞在肠道中浸润,但此时视网膜中没有明显的CFSE信号;图8D~F结果显示,重建14天后,CFSE标记细胞从肠道中消失,到达视网膜。
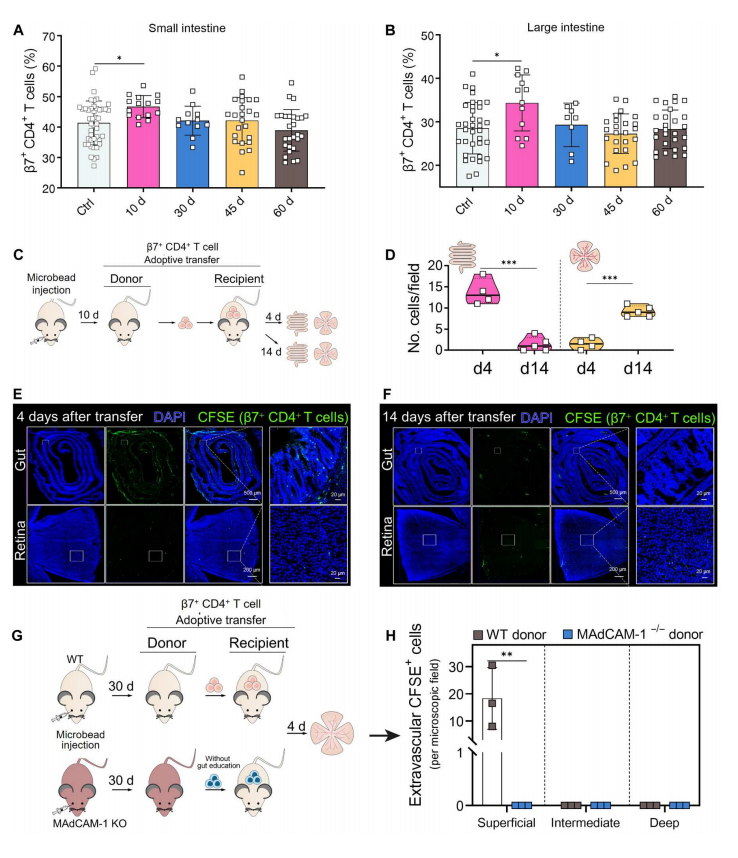
接着,我们从图8G~H观察到,从EIOP诱导的WT或MAdCAM-1−/−小鼠中分离出β7+ CD4+ 30d T细胞,并将其转移到WT受体小鼠。图8H结果显示,来自MAdCAM-1−/−供体的β7+ CD4+ 30d T细胞在移植后4天未能侵入受体视网膜,但来自WT供体的β7+ CD4+ 30d T细胞可以浸润RGC所在的浅层。这些数据表明,β7+ CD4+ T细胞归巢到肠道是它们进入视网膜的必要条件,并解释了为什么无菌肠道环境的小鼠对进行性青光眼RGC损伤具有抵抗力。
四、研究总结
作者通过研究发现在青光眼患者中,表达肠道归巢整合素β7的循环CD4+ T细胞的百分比增加,并与疾病分期相关。接着又在EIOP触发的青光眼小鼠模型中发现,β7+ CD4+ T细胞通过诱导视网膜内皮细胞中MAdCAM-1的表达,在青光眼的进展期浸润视网膜。由于MAdCAM-1在健康小鼠的视网膜中检测出最低限度,所以用MAdCAM-1抗体中和改善了青光眼小鼠RGC的丢失和胶质活性。接着作者又通过研究进一步发现,EIOP诱导的β7+ CD4+ T细胞在青光眼急性期归巢于肠道,这对患病小鼠的进行性RGC损伤至关重要。然后,作者将肠道归巢的β7+ CD4+ T细胞进行了转录重编程,并显示出在自身免疫性疾病、细菌反应、黏膜免疫和胶质细胞活性中富集的上调通路。然后通过引导β7+ CD4+ T细胞获得了诱导视网膜MAdCAM-1表达和跨越血-视网膜屏障的能力。最终该研究揭示了经肠道许可的β7+ CD4+ T细胞和MAdCAM-1的作用,并强调了“肠-视网膜”轴在青光眼中的重要性。
五、相关国自然中标项目

 文章推荐
文章推荐