
免疫组化(简称IHC)是一种利用特异性抗体与抗原结合的原理,通过特定的显色反应来检测组织或细胞中的特定化学成分或性质的组织化学技术。这种技术通过显微镜观察颜色变化,以确定抗原-抗体结合的位置。
实验流程主要包括以下步骤:切片制作(固定,脱水,透明,包埋,切片,贴片,烤片),脱蜡,水化,阻断,抗原修复,封闭,一抗孵育,二抗孵育,显色,复染,封片,分析。
尽管实验步骤每一步都很清楚,但是实操过程中常常不会尽如人意,总是出现问题,所以下面小编按照过程整理了常会出现的问题和建议,需要的小伙伴可以码住!
一、组织固定
组织固定不及时或不充分,HE染色细胞核模糊,对比不鲜明;免疫组化染色中,组织离体2h后抗原完全丢失。
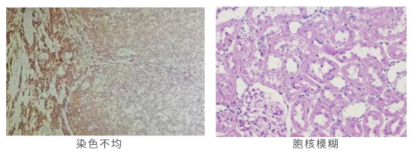
问题1-染色不均:组织固定不充分,淋巴结边缘淋巴细胞染色强阳性,组织内部淋巴细胞染色弱阳性,染色不均。
问题2-胞核模糊:固定不及时或固定不完全,细胞核模糊,对比不鲜明。
建议:
1. 为确保实验结果的准确性,建议在组织离体后立即进行固定处理。推荐组织块大小控制在15x15x5mm范围内,以优化切开固定的效果。
2. 在固定液的选择上,推荐使用10%中性福尔马林缓冲液,以确保固定效果达到最佳状态。
3. 固定时间应控制在4h至24h之间,长时间固定可能会对抗原决定簇的暴露产生不利影响,从而导致阴性结果的产生。
4. 固定液的量应确保超过组织体积的五倍以上,以确保固定过程充分且均匀。
二、脱水浸蜡
问题:在组织处理流程中,若脱水与浸蜡过程未能达到充分标准,将导致蜡块中的组织产生明显的收缩和凹陷,进而在后续的免疫组化热抗原修复操作中,这些蜡块将面临更高的脱片风险。

建议:
1. 在进行梯度酒精脱水时,务必确保脱水过程尽可能彻底且充分。
2. 关于二甲苯透明的时间控制,应避免过长,推荐时长为1至3小时,透明过度可能会引发组织变硬变脆。
3. 浸蜡过程中,应当选择低熔点的石蜡,并确保浸蜡过程充分。
三、切捞烤三部曲
切片太厚,有刀痕,有褶皱,脱片。
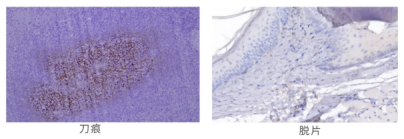
问题1-刀痕:有刀痕,影响结果的判读
问题2-脱片:烤片时间不足。
建议:
1. 切片厚度需根据组织特性调整,淋巴结、肾等需薄切(<3um),脑组织需厚切(6~8um),其他组织如胃肠道、肝胆等选择2~4um。切片角度和刀片新旧影响切片效果,需根据切片机型号调整角度,新刀片效果更好。
2. 捞片应无皱折、无气泡,水温约40℃。
3. 粘片使用蛋白甘油(1:1调配),涂抹于载玻片上,从水中捞起蜡片,烘干或进行防脱处理。
4. 烘干温度50℃,时间12~24h。
四、脱蜡不充分
问题:在观测过程中,发现了脱蜡处理不完全的情况,这导致组织出现了异染现象。异染现象通常表现为苏木素着色效果不理想,即HE染色过程中缺乏选择性,使得染色结果呈现不均匀的状态。同时,也存在部分样本在伊红染色过程中无法成功上色的情况。
建议:
1. 根据不同的室温,调节脱蜡的时间,原则上是要彻底、干净、完全地脱去切片上的蜡。
2. 在针对脱蜡过程进行操作时,需根据实时的室温条件,科学合理地调整脱蜡时间,其核心目标在于确保切片上的蜡层被彻底、干净、无残留地去除,以达到最佳的脱蜡效果。
五、抗原修复
阳性检测率以及着色强度均显示出相对减弱的趋势。
问题:在不同组织环境下,抗原修复液的PH值变化会直接影响抗原的染色结果强度。具体而言,存在三种典型的反应模式:首先是A型抗原,其染色强度在抗原修复液PH值变化时保持稳定,未表现出显著变化;其次是B型抗原,随着抗原修复液PH值的升高,其染色强度会经历先降低后升高的过程;最后是C型抗原,其染色强度会随着抗原修复液PH值的升高而相应增强。
举例:在相同组织样本中,应用不同PH值的抗原修复液会导致其结果在染色强度上呈现出显著的差异性。
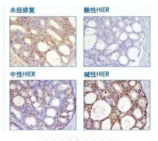
建议:
1. 在抗原修复缓冲液的选择上,存在多种类型,其中常用的包括柠檬酸盐缓冲液(pH6.0)、EDTA缓冲液(pH8.0~9.0)、Tris/Tris-EDTA缓冲液(pH9.0~10.0),以及胰酶法(pH3.5±0.2)。
2. 修复液的不同PH值对最终的染色结果具有显著影响。
3. 没有任何一种抗原修复缓冲液能够普遍适用于所有抗原。
4. 当修复液的DH值位于8.0-9.0的范围时,大部分抗原能够获得较为理想的修复效果,因此碱性缓冲液在应用中较为普遍。
六、封闭
1. 封闭剂的选择应基于二抗系统中是否包含生物素作为依据。
2. 对于不含生物素的二抗系统,可以不使用封闭剂。
3. 对于卵白素类的二抗系统,应根据生物素的种类精确选择相应的封闭剂并在一抗前对组织切片进行预处理。
4. 封闭时间过长,可能导致阳性信号减弱,极端情况下可能出现假阴性结果。
5. 封闭时间不足,可能导致背景信号增强,极端情况下可能出现假阳性结果。
七、洗涤
问题:染色液的堆积。
建议:充分洗涤。
八、干片
问题:干片导致的假阴性。
建议:加入Tween-20的缓冲液能够更好地防止切片干燥。
九、边缘效应
问题:边缘效应造成的非特异性染色。
建议:组织切片与玻片黏贴牢固,试剂完全覆盖组织防止干片,加入Tween-20的缓冲液能够更好地防止边缘效应。
十、加入一抗
一抗的重要性极为显著,其基本原则在于选择具备高度特异性、高灵敏度以及低背景噪声的抗体,确保所得结果稳定可靠,且具有良好的重复再现性。
1. 特异性
在抗体的筛选过程中,确保抗体的特异性是至关重要的原则。鉴于不同抗体具有各异的特异性,包括组织特异性、细胞特异性以及细胞亚定位的特异性,因此,对这些特异性的准确把控是不可或缺的。
2. 染色强度
适当调整抗体稀释比,或者选择染色强度高、亲和力高的抗体
3. 浓度
在抗体的筛选过程中,确保抗体的特异性是至关重要的原则。鉴于不同抗体具有各异的特异性,包括组织特异性、细胞特异性以及细胞亚定位的特异性,因此,对这些特异性的准确把控是不可或缺的。
4. 孵育条件
孵育条件对染色结果略有影响,需筛选合适的孵育条件。
十一、加入二抗
在各种显色系统中,由于采用的技术和原理不同,显色结果亦呈现出显著的差异。其中,多聚物酶标记二抗相较于传统的HRP直标二抗,在灵敏度上表现出更高的优越性,同时背景更为清晰,对比效果更加显著。这种技术在提高检测准确度和清晰度方面,具有显著的优势和实际应用价值。
十二、DAB显色
1. 沉淀
(1) 问题:产生深棕至黑色的DAB絮状或团状沉积于组织切片上。
(2) 建议:
① DAB显色液应现配现用,避免DAB沉积导致样本上深棕色絮状沉淀干扰结果。
② 显色时间应根据反应情况灵活调整,最好是滴加了DAB显色液后置于显微镜下控制显色时间。
2. 信号偏弱
建议适当延长显色时间,滴加了DAB显色液后置于显微镜下控制显色时间。
十三、苏木素如何使用
1.关于苏木素配方的染色时间,各种配方之间存在显著差异。不仅如此,配方的新旧程度亦对染色时间有直接影响。
2.在国际范围内,Harris苏木素被广泛使用,其配方中含有汞元素,因此,在染色过程中通常需要进行分化与返蓝的步骤,尽管如此,其颜色表现却尤为亮丽。
3.经过改良的Mayer苏木素配方则无需进行分化步骤,其染色时间可根据配置的时间灵活调整,通常在15秒至2分钟之间。
 文章推荐
文章推荐