

蛋白质印迹法概述
蛋白质印迹能够灵敏地检测含有多种蛋白质的溶液中的特定蛋白质。这是一项基本的生物学技术,也是可用于分析蛋白质的最便宜的方法之一。要进行蛋白质印迹,首先通过凝胶电泳根据蛋白质的质量和电荷分离蛋白质,然后用特异性抗体检测选择的蛋白质。通常,研究人员将使用蛋白质印迹从细胞培养基或细胞裂解物中分离蛋白质。例如,如果您想了解您的细胞表达了多少肌动蛋白,蛋白质印迹可以轻松比较不同细胞类型之间的肌动蛋白量。在哺乳动物和昆虫细胞中生产蛋白质时,您也可能会使用蛋白质印迹。
在典型的蛋白质印迹程序中,首先裂解细胞并使用分光光度计确定蛋白质的量。然后将制成凝胶并将细胞裂解物中的总蛋白质加载到凝胶的孔中。施加电场后,凝胶中的蛋白质将开始向下迁移并根据蛋白质的大小和电荷分离成不同的条带。在最小的蛋白质到达凝胶底部后,电泳将停止,凝胶上的所有蛋白质都将转移到印迹纸上,以便于处理。最后,将添加识别目标蛋白质的抗体,并通过化学发光进行检测。
相关文章:
利用蛋白质偶联化学修饰蛋白质并在荧光蛋白质印迹上可视化它们
以下是如何进行蛋白质印迹的分步说明:

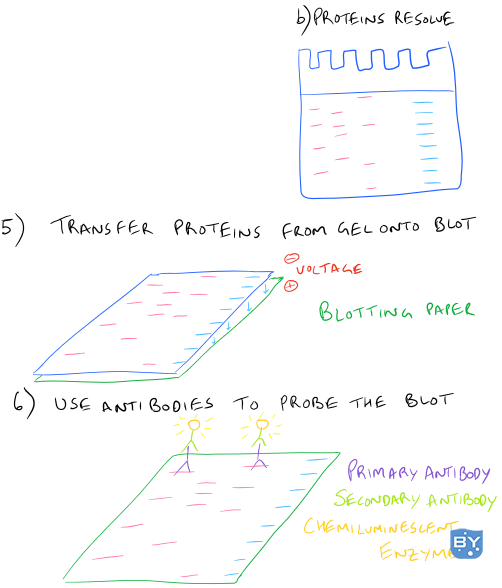
SDS-PAGE Western Blot 分步实验方案
蛋白质印迹法可用于检查 RCAN1 的上调,RCAN1 是神经元细胞类型中的一种信号分子。
蛋白质印迹材料:
兔抗 RCAN1 抗体(#SAB2101967,Sigma-Aldrich)
SDS-PAGE 凝胶(Criterion TGX precast Stain-free Any kD 凝胶,#5678124,Bio-Rad)
TBS (20 mM TrisCl pH 7.6, 150 mM NaCl)
运行缓冲液(25 mM Tris、192 mM 甘氨酸、0.1% SDS)
转移缓冲液(25 mM Tris、192 mM 甘氨酸、20% 甲醇、0.05% SDS)
4X SDS-PAGE 上样缓冲液(Laemmli 的样品缓冲液 #1610747 Bio-Rad;在实验当天添加新鲜的二硫苏糖醇至 10 mg/ml)
转移膜(0.2 um 聚偏二氟乙烯膜,#03010040001 Roche)
二抗(驴抗兔辣根过氧化物酶偶联物;#711-035-152 Jackson ImmunoResearch)
封闭缓冲液(含 0.1% Tween20 的 TBS 中的 5% 脱脂奶粉)
Immun-Star WesternC 化学发光反应溶液 (#170-5070 Bio-Rad)
双色梯 (#1610374 Bio-Rad)
吸墨纸(ProteanXL,#1703966 Bio-Rad)
蛋白质印迹实验程序:
打开预制凝胶并用运行缓冲液冲洗孔 3 次。在罐中组装凝胶并填充运行缓冲液。*
在 Eppendorf 管中,将蛋白质样品 (30 µg) 添加到 10 µl 4X SDS-PAGE 上样缓冲液中,并加水至最终体积为 40 µl。
将样品加热至 95°C 2 分钟并短暂旋转以确保内容物在管底部
用样品加载凝胶,并在一个泳道中包括梯子。
在 200V 下运行凝胶 30 分钟。
凝胶运行时,将两张吸墨纸(切成与凝胶相同的大小)浸泡在转移缓冲液中(约 30 分钟)。浸入甲醇中激活转印膜(也切成一定尺寸),然后在转印缓冲液中浸泡约 10 分钟。10 分钟。
从罐中取出凝胶并放入转移缓冲液中。
将浸泡过的吸墨纸、转印膜、凝胶和吸墨纸放在打开的转印盒(Turbo Blot 转印单元;Bio-Rad)上,组装转印“三明治”。使用玻璃棒在“三明治”上滚动以去除任何气泡。
关闭盒式磁带并在机器中运行(标准 minigel 程序 30 分钟)。
从盒中取出转印膜,小心剪断一个角以确保方向。*
将转移膜在封闭缓冲液中在 4°C 下摇动孵育 1 小时。
倒出封闭缓冲液并在 5 ml TBS 中以 1:200 的比例添加稀释的抗 RCAN1 抗体,其中含有 2.5% 脱脂奶粉和 0.05% Tween20。在 4C 下摇动孵育过夜。
用 0.2% Tween20 在 TBS 中洗涤膜 3 次,在 4°C 下摇动,每次 10 分钟。
与稀释的二抗 1:2500 在 5 ml TBS 中与 0.2% Tween20 一起在 4°C 下孵育 1 小时。
用 0.2% Tween20 在 TBS 中洗涤膜 3 次,在 4°C 下摇动,每次 10 分钟。在水中短暂冲洗膜。
在用箔包裹的管中混合 1 ml 每种 ECL 试剂,并在 ChemiDoc MP 成像仪 (Bio-Rad) 上成像之前添加到膜中 5 分钟。
此 Western Blot 方法的程序说明:
这种预制凝胶包含 18 个泳道,每孔最多 30 ul 的上样能力为 10-40 ug 蛋白质
可以将小的针点标记与颜色标记一起添加到膜上,在随后的孵育和洗涤步骤后强度会降低。
为确保您知道自己处于哪一步,请在运行凝胶电泳后切割凝胶的右下方。
在这种方法中,蛋白质在凝胶上电泳之前先变性。这称为 SDS-PAGE。通过变性,您可以确保大小和电荷都是最重要的,与天然凝胶电泳相反,蛋白质的构象也很重要。
通过使用剥离缓冲液可以再生印迹(可以去除用于探测的抗体)。然而,印迹只能剥离几次,因为它们的背景噪音太多而无法轻松分析。
 文章推荐
文章推荐