
作为近年来CNS期刊的热点和国自然的热门,表观遗传学的研究受到了很高的重视。我们都知道,基因是决定细胞功能和遗传特征的基础,但遗传信息不仅仅是由碱基序列所决定的,还受到其他较小但同样重要的遗传调节机制的控制。其中,DNA甲基化是一种最为普遍但也最容易被忽视的调节方式。
DNA甲基化作为一种较为微观的遗传调节机制,其影响着许多日常生活中不可忽视的方面,例如疾病、学习能力和环境等。DNA甲基化是怎么被发现的?5mC甲基化又是如何产生的呢?
想知道问题的答案就继续往下看吧~
一、5mC的发现历程
1925年Johnson and Coghill在结核分枝杆菌中首次发现5mC;1948年,Hotchkiss在小牛胸腺DNA色谱仪上观察到胞嘧啶附近的微弱条带;20世纪60-70年代,5mC引起人们的重视;20世纪80年代,开始探讨5mC影响基因的表达;20世纪90年代,目光主要聚焦在DNA甲基转移酶上;21世纪初,开始进一步探讨5mC与其他表观遗传学修饰的关系。
二、5mC的参与者
在哺乳动物中,DNA甲基化一般分为5-甲基胞嘧(5mC)、5-羟甲基胞嘧啶(5hmC)、5-甲酰胞嘧啶(5fC)和5-羧基胞嘧啶(5caC)。其中,5fC和5caC极为罕见,可被胸腺嘧啶DNA糖苷酶(TDG)瞬时去除,因此它们被推测为DNA脱甲基的活性中间体。
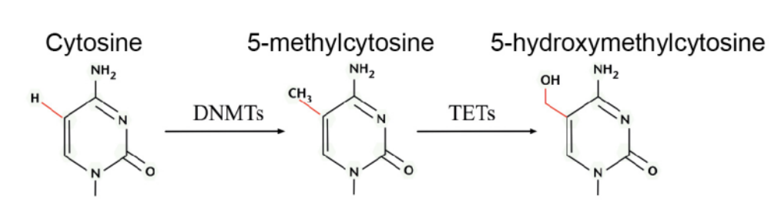
在病理生理状态下,基因组重复卫星区域的全局DNA低甲基化和肿瘤抑制基因启动子处CGI的位点特异性高甲基化,是人类癌症的标志,与全基因组的不稳定性相关。
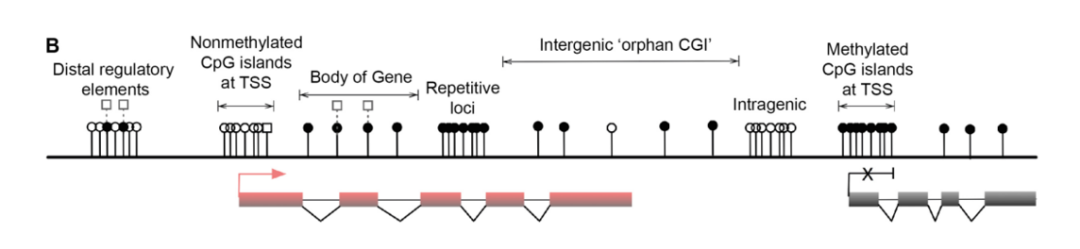
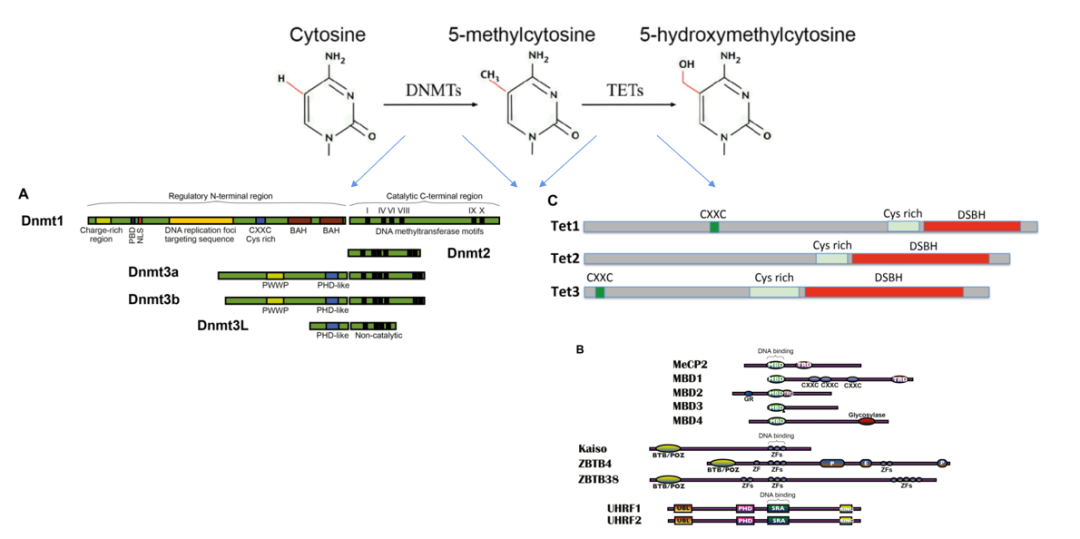
下图中,DNMTss为甲基转移酶家族,TET家族起eraser作用。其中DNMT1、DNMT3A和DNMT3B在哺乳动物DNA甲基化的建立和维持中起协调作用。
而CpG上的“书面”甲基化标记是可以被各种methyl-CpG binding proteins (MeCPs)特异性识别。MeCPs可“读取”已建立的甲基化DNA序列,并招募组蛋白修饰复合物来调节染色质结构,从而稳定基因表达的模式。
哺乳动物的MeCPs主要有三个特征家族,分别是MeCP2、MBD1、MBD2和MBD4。它们能通过新的结构域特异性识别5meCpG。
三、案例分析
今天带领大家阅读是一篇题为“systemic lupus erythematosus (SLE)系统性红斑狼疮外周血PBMC中TET2启动子区甲基化与global低甲基化和低羟甲基化”的文章。事不宜迟,一起来了解一下作者的实验思路吧~

(1)
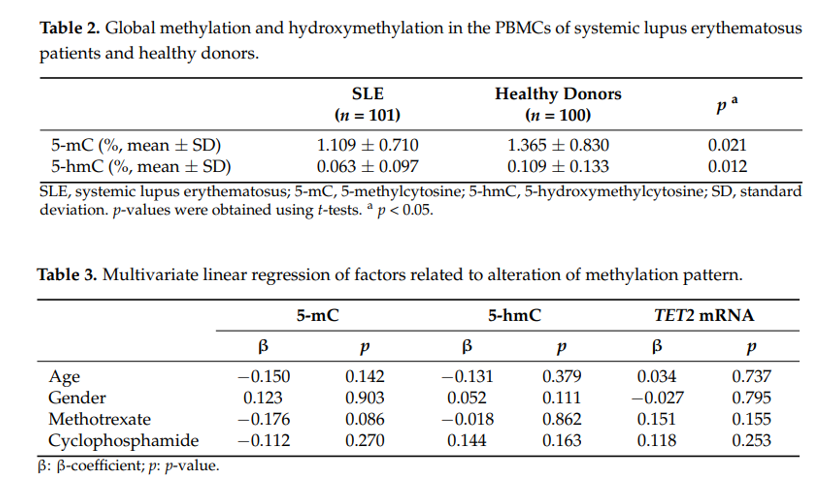
作者首先征集了101名系统性红斑狼疮(SLE)患者和100名正常人作为受试者,对他们外周血中PBMC 5mC、5hmC Global以及5hmC相关TET家族的mRNA水平进行检测。
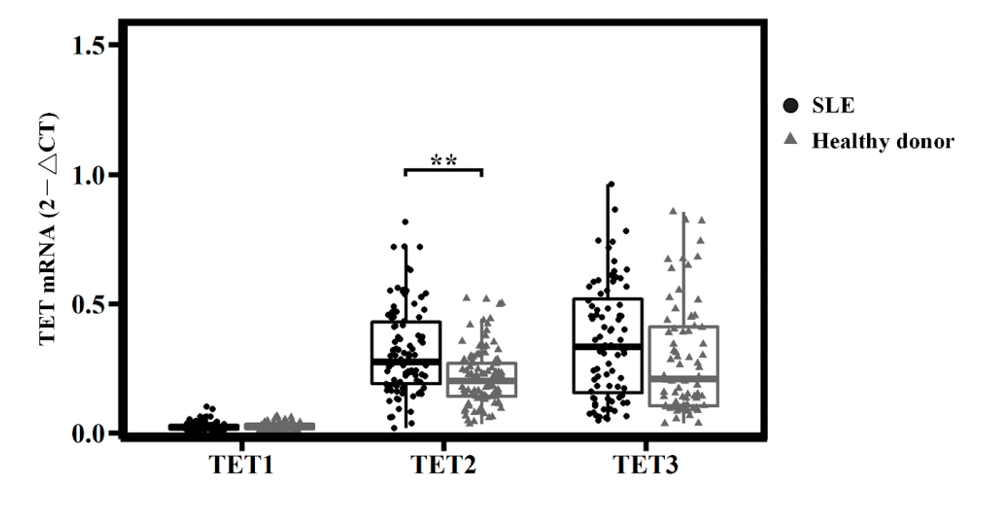
实验结果发现,SLE患者中,TET2和TET3的表达水平显著高于TET1,尤其是TET2的表达水平显著升高。因此,作者锁定TET2作为研究对象。
(2)
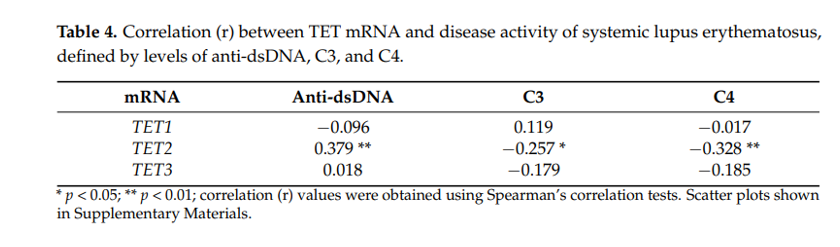
接下来作者以抗dsDNA作为SLE疾病活动的标记物,进行了dsDNA抗体性能比较与临床评价。实验结果表明TET2与疾病活动性相关。
(3)
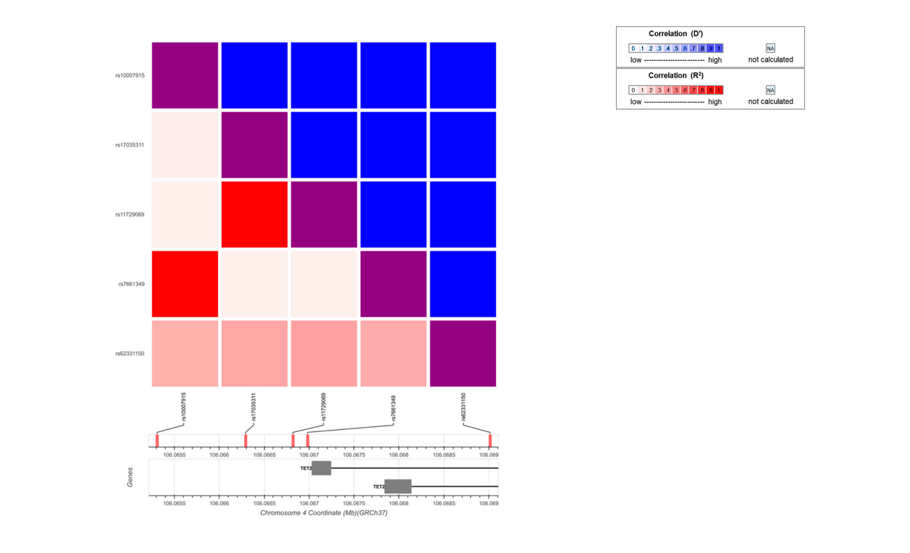
为了进一步证明SNP是否导致SLE患者TET2 mRNA表达增加,作者选择了5个SNPs继续进行实验。然而,实验结果表明,5个SNPs均与TET2 mRNA表达增加无关。
(4)
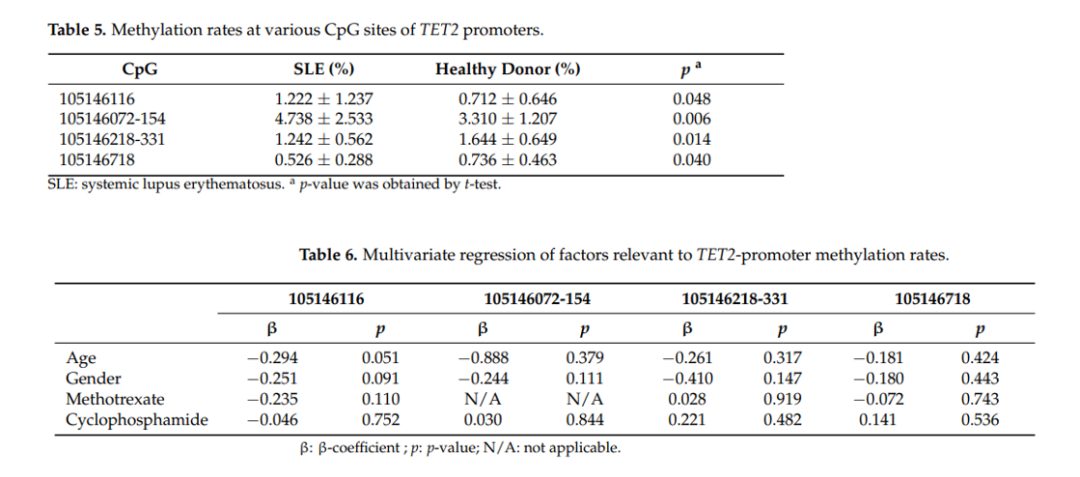
最后,作者发现SLE患者其中两个位点上甲基化率与正常人有显著差异,他 认为甲基化率可能受年龄、性别或药物影响,因此设计实验检测了TET2启动子中40个CpG位点。但最终结果表明,SLE患者TET2启动子区CpG岛甲基化的上调,与年龄、性别、用药均无关。
今天的内容到这里就结束啦!你学会了吗~
 文章推荐
文章推荐